
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
C) разрушение кристаллической решётки – диссоциация хлорида натрия
|
|
|
|
Механизм электролитической диссоциации
например, в керосине. Как это объяснить?
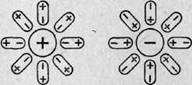
В молекуле воды связи между атомами водорода и атомами кислорода ковалентные полярные. Электронные пары, связывающие атомы. Смещены от атома водорода к атому кислорода. На атомах водорода поэтому сосредоточен положительный заряд, а на атоме кислорода – отрицательный.
Для рассмотрения механизма диссоциации электролитов нужно учитывать не только полярность в молекуле воды связей между атомами водорода и кислорода. Но и полярность самой молекулы воды. Полярную молекулу воды – диполь – можно изображать в виде эллипса с указанием зарядов на полюсах с указанием зарядов на полюсах знаками «+» и «–».
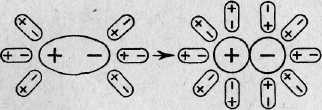
Рассмотрим механизм диссоциации веществ с ионным видом связи на примере хлорида натрия. Он состоит из трёх этапов:
a) ориентация полярных молекул воды (диполей) вокруг кристалла и расшатывание кристаллической решётки под действием хаотичного движения молекул воды; (при погружении кристалла соли в воду молекулы воды притягиваются к ионам, находящимся на поверхности кристалла: к положительным ионам своими отрицательными полюсами (атомы кислорода), а к отрицательным ионам – положительными полюсами (атомы водорода).
b) гидратация – окружение молекулами воды ионов натрия и хлора (образование гидратированных ионов);
(притянувшись к ионам растворяемой соли молекулы воды во много раз ослабляют притяжение ионов друг к другу. Связи между положительными и отрицательными ионами в кристаллической решетке разрываются. Происходит разъединение гидратированных ионов)
Молекулы воды, притянувшиеся к ионам при растворении кристалла, остаются связанными с ними и в растворе.
Механизм диссоциации веществ с ковалентной полярной связью включает в себя дополнительный этап:
ориентация полярных молекул воды вокруг полярной молекулы электролита;
изменение вида связи с ковалентной полярной на ионную;
диссоциация электролита;
гидратация ионов.
4) Не все электролиты в равной мере диссоциируют на ионы. В растворах электролитов наряду с ионами могут присутствовать и молекулы. Степень диссоциации a – это отношение молекул, распавшихся на ионы, к общему числу молекул в растворе a = n/N,
где n – число диссоциированных молекул, N – общее число молекул в растворе.
Сильные электролиты при растворении в воде практически полностью диссоциируют на ионы. У них a стремится к единице. К сильным электролитам относятся: все растворимые соли, кислоты H2SO4, HNO3, HCl, все щелочи.
Слабые электролиты при растворении в воде почти не диссоциируют на ионы. У них aстремится к нулю. К слабым электролитам относятся: слабые кислоты – H2S, H2CO3, H2SO3, HNO2, NH3 ·H2O, вода.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 1207; Нарушение авторских прав?; Мы поможем в написании вашей работы!