
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Коагуляция
|
|
|
|
Устойчивость золи можно нарушить устранив одноименный заряд и защитную гидратную (сольватную) оболочку. Наиболее важное теоретическое и практическое значение имеет коагуляции при добавлении электролита.
[m(AgI)n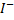 x
x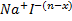 +(n-x)
+(n-x)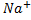 *z(
*z(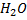 )+
)+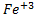 +3
+3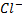 =[m(AgI)n
=[m(AgI)n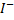 n
n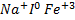 +3
+3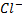 *z(
*z(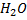 )
)
Введенный в коллоидный раствор электролит дегредатирует ионы диффузного слоя ((n-x) n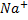 *z(
*z(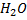 )), способствуя переходу их в адсорбционный слой. Это вызывает уменьшение заряда коллоидных частиц, силл отталкивания, все это способствует слипанию и укрупнению частиц.
)), способствуя переходу их в адсорбционный слой. Это вызывает уменьшение заряда коллоидных частиц, силл отталкивания, все это способствует слипанию и укрупнению частиц.
Коагулирующей частью электролита является один из его ионов-тот, который несет противоположный по знаку заряд коллоидной частицы. Т.о. для золи отрицательно заряженных частиц коагулирующим ионов являются катионы,а для золи с положительными частицами-анионы. При добавлении малой концентрации электролита начальная стадия процесса коагуляции протекает незаметно для невооруженного глаза, и называется потому скрытой(неявной) коагуляцией.
Для начала явной (заметной) коагуляции необходимо, чтобы концентрация электролита превысила некоторую минимальную величину, называемую порогом коагуляции 𝛾 [моль/литр]
Коагулирующая способность электролита (иона) неодинакова и может быть определена, как величина, обратная порогу коагуляци
К.С.=
В настоящее время общепризнанной является теория коагуляции электролита, теория ДЛФО-Б.В. Дерянин, Л.Д. Лондау, Феервей, Овербек.
Физическая теория коагуляции электролитами строится на рассмотрении баланса минимолекулярных сил притяжения и сил ионноэлектростатического отталкивания. Отсюда, общая энергия взаимодействия складывается из энергии приземления и энергии отталкивания U=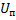 -
-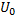
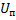 -потенциальная энергия дисперсного взаимодействиям
-потенциальная энергия дисперсного взаимодействиям
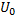 – потенциальная энергия дисперсного отталкивания
– потенциальная энергия дисперсного отталкивания
Если 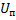 >
>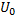 – коллоидные частицы, сталкивающиеся при броуновском движении, слипаются.
– коллоидные частицы, сталкивающиеся при броуновском движении, слипаются.
Если 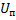 <
<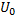 – коллоидные частицы отталкиваются, дисперсная система устойчива.
– коллоидные частицы отталкиваются, дисперсная система устойчива.
Из теории ДЛФО было получено соотношение порога коагуляции и заряда коагулируемого иона – порог коагуляции обратнопропорционален степени заряда коагулирующего иона.
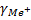 +
+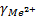 +
+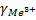 =1:
=1: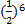 :
: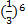
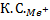 :
: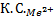 :
: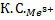 =1:64:729
=1:64:729
Этот ряд согласуется с опытными данными, получившими свое выражение в правиле Шульца-Гарди:
Чем выше заряд коагулирующего иона, тем сильнее выражена его коагулирующая способность и тем ниже порог коагуляции.
На практике было получено для некоторых металлов: 1:20:350
Зависимость получается другой, однако основная закономерность и порядок величин, характеризующих коагуляцию сохраняется.
Коагулирующая спсобность ионов одного и того же заряда зависит и от природы иона.
При коагуляции отрицательно заряженных золей однозарядные ионы образуют последовательный ряд в порядке уменьшения их коагулирующей способрости:
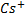 ;Rb;K;Na
;Rb;K;Na
При коагуляции положительных золей, одновалентные ионы образуют следующий ряд:
Cl; Br; 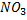 ; I
; I
Такие ряды называются лиотропными.
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 431; Нарушение авторских прав?; Мы поможем в написании вашей работы!