
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция № 7. Энергетика химических процессов
|
|
|
|
Химическая реакция – это процесс, при котором одни соединения разлагаются, другие образуются, в результате одни химические связи заменяются другими. Как следствие химические реакции сопровождаются выделением или поглощением теплоты. Реакции, протекающие с выделением теплоты в окружающую среду, называются экзотермическими, а с поглощением теплоты – эндотермическими. Количество теплоты, которое выделяется или поглощается при химической реакции, называется тепловым эффектомреакции.
Тепловой эффект реакции, протекающей в условиях р=const, T=const, равен изменению энтальпии системы ∆Н и измеряется в кДж. При экзотермической реакции энтальпия системы уменьшается и ∆Н < 0, а при эндотермической – энтальпия системы увеличивается и ∆Н > 0.
Если исходные вещества и продукты реакции находятся в стандартном состоянии, то энтальпию реакции называют стандартной и обозначают ∆Н0 или ∆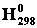 . Верхний индекс отвечает стандартному давлению (101кПа), нижний индекс соответствует стандартной температуре, принятой по международному соглашению, равной 298 К.
. Верхний индекс отвечает стандартному давлению (101кПа), нижний индекс соответствует стандартной температуре, принятой по международному соглашению, равной 298 К.
Уравнения химических реакций, в которых указаны изменения энтальпии (тепловые эффекты реакций), называются термохимическими.
Например, термохимическое уравнение
N2(г) + 3Н2 (г) = 2NH3 (г), ∆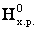 = –92, 4 кДж.
= –92, 4 кДж.
показывает, что при взаимодействии 1 моль N2 и 3 моль Н2 образуется 2 моль NH3 и выделяется количество теплоты, равное 92,4 кДж.
Термохимические уравнения подчиняются закону Лавуазье-Лапласа: тепловой эффект прямой реакции равен по абсолютному значению и противоположен по знаку тепловому эффекту обратной реакции.
Закон Лавуазье-Лапласа носит частный характер, в основе термохимических расчетов лежит фундаментальный закон термохимии – закон Гесса: тепловой эффект химической реакции зависит только от начального и конечного состояний веществ и не зависит от промежуточных стадий процесса.
Из закона Гесса следует два важных следствия.
Первое следствие: тепловой эффект получения любого вещества не зависит от способа его получения. Так как энтальпия образования вещества зависит от его состояния и от условий, все энтальпии образования отнесены к одинаковым состояниям и условиям, которые называют стандартными. Стандартная энтальпия реакции образования 1 моля сложного вещества из простых веществ, устойчивых при 298 К и давлении 101 кПа называется стандартной энтальпией образования. Обозначается ∆ 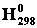 или ∆Н0 (температуру 298 К можно опустить), измеряется в кДж/моль. Следует отметить, ∆Н0простых веществ равна нулю.
или ∆Н0 (температуру 298 К можно опустить), измеряется в кДж/моль. Следует отметить, ∆Н0простых веществ равна нулю.
В термохимических расчетах более часто применяют второе следствие из закона Гесса: энтальпия химической реакции равна сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учетом стехиометрических коэффициентов реакции. Например, стандартная энтальпия реакции aA+bB=сС+dD определяется по формуле:
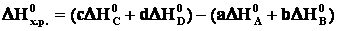 ,
,
где ∆Н0 – стандартная энтальпия образования соединения.
Направление протекания химической реакции определяет энергия Гиббса (∆G). При р=const, T=const реакция самопроизвольно протекает в том направлении, которому отвечает убыль энергии Гиббса. Если ∆G < 0, то реакциясамопроизвольно протекает в прямом направлении. Если ∆G > 0, то самопроизвольное протекание процесса в прямом направлении невозможно. Если ∆G = 0, то реакция может протекать как в прямом направлении, так и в обратном, и система находится в состоянии равновесия.Изменение ∆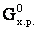 не зависит от пути процесса и может быть рассчитано по следствию из закона Гесса: изменение энергии Гиббса в результате химической реакции равно сумме энергий Гиббса образования продуктов реакции за вычетом суммы энергий Гиббса образования исходных веществ с учетом стехиометрических коэффициентов. Например, стандартная энергия Гиббса реакции aA + bB = сС
не зависит от пути процесса и может быть рассчитано по следствию из закона Гесса: изменение энергии Гиббса в результате химической реакции равно сумме энергий Гиббса образования продуктов реакции за вычетом суммы энергий Гиббса образования исходных веществ с учетом стехиометрических коэффициентов. Например, стандартная энергия Гиббса реакции aA + bB = сС
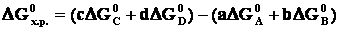 ,
,
где ∆G0 – стандартная энергия Гиббса образования вещества, кДж/моль. Энергия Гиббса образования простых веществ равна нулю. ∆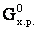 имеет ту же размерность, что и энтальпия, и поэтому обычно выражается в кДж.
имеет ту же размерность, что и энтальпия, и поэтому обычно выражается в кДж.
Изменение стандартной энергии Гиббса химической реакции может быть также вычислено по уравнению:
∆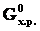 = ∆
= ∆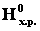 – Т∆
– Т∆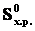 ,
,
где Т – абсолютная температура, ∆ 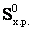 – изменениеэнтропии.
– изменениеэнтропии.
Энтропия – это мера неупорядоченности состояния системы; стремление частиц (молекул, ионов, атомов) к хаотическому движению, а системы – к переходу от более упорядоченного состояния к менее упорядоченному. Энтропия возрастает с увеличением движения частиц при нагревании, испарении, плавлении, расширении газа, при ослаблении или разрыве связей между атомами и т.п. Процессы, связанные с упорядоченностью системы (конденсация, кристаллизация, сжатие, упрочнение связей, полимеризация), сопровождаются уменьшением энтропии. Измеряется энтропия в Дж/моль×К.
Изменение энтропии системы в результате протекания химической реакции (∆S) (энтропия реакции) равно сумме энтропий продуктов реакции за вычетом суммы энтропий исходных веществ с учетом стехиометрических коэффициентов. Изменение энтропии в результате протекания химической реакции aA + bB = сС + dD:
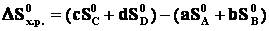 .
.
Энтропия также является критерием возможности самопроизвольного протекания процесса: в изолированной системе самопроизвольно могут протекать только такие процессы, которые ведут к увеличению неупорядоченности системы, т.е. к росту энтропии.
При химическом взаимодействии одновременно изменяется энтальпия, характеризующая стремление системы к порядку, и энтропия, характеризующая стремление системы к беспорядку. Если тенденции к порядку и беспорядку в системе одинаковы, то ∆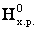 = Т∆
= Т∆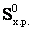 , что является условием равновесного состояния системы. Если пренебречь изменениями ∆H0х.р. и ∆S0х.р с увеличением температуры, то можно определить температуру, при которой устанавливается равновесие химической реакции для стандартного состояния реагентов:
, что является условием равновесного состояния системы. Если пренебречь изменениями ∆H0х.р. и ∆S0х.р с увеличением температуры, то можно определить температуру, при которой устанавливается равновесие химической реакции для стандартного состояния реагентов:
Травн. = 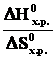
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 628; Нарушение авторских прав?; Мы поможем в написании вашей работы!