
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Концентрация растворов
|
|
|
|
Давление
Температура
Природа растворителя
Природа растворяемого вещества.
Кристаллические вещества подразделяются на:
P – хорошо растворимые (более 1,0 г на 100 г воды);
M – малорастворимые (0,1 г – 1,0 г на 100 г воды);
Н – нерастворимые (менее 0,1 г на 100 г воды).
При образовании раствора связи между частицами каждого из компонентов заменяются связями между частицами разных компонентов. Чтобы новые связи могли образоваться, компоненты раствора должны иметь однотипные связи, т.е. быть одной природы. Поэтому ионные вещества хорошо растворяются в полярных растворителях и плохо в неполярных, а молекулярные вещества – наоборот.
Для большинства солей характерно увеличение растворимости при нагревании. Растворимость газов в жидкостях с повышением температуры уменьшается, а с понижением увеличивается.
С повышением давления растворимость газов в жидкостях увеличивается, а с понижением уменьшается.
Важной характеристикой любого раствора является его состав, который определяется количеством растворенного вещества и растворителя. Отношение количества или массы вещества, содержащегося в системе, к объему или массе этой системы называется концентрацией. Известно несколько способов выражения концентрации растворов.
Массовая доля растворённого вещества w – это величина, равная отношению массы растворённого вещества к общей массе раствора:
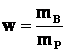
где mВ и mр – соответственно масса растворенного вещества и масса раствора. Массовую долю растворённого вещества w обычно выражают в долях или в процентах.
Молярная концентрация Cм (молярность М) – отношение количества растворенного вещества к объему раствора:
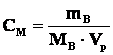 ,
,
где mB – масса растворенного вещества, МВ – молярная масса растворенного вещества, Vр – объем раствора. Единица измерения молярной концентрации – моль/л.
Нормальная концентрация Сн (нормальность н.) – отношение количества эквивалентов растворенного вещества к объему раствора:
 ,
,
где, mB – масса растворенного вещества, Мэ(В) – молярная масса эквивалентов растворенного вещества, Vр – объем раствора. Единица измерения нормальной концентрации − г-экв/л.
Моляльная концентрация Сm (моляльность) – отношение количества растворенного вещества к массе растворителя:
 ,
,
где mB – масса растворенного вещества, mS – масса растворителя, МВ – молярная масса растворенного вещества. Единица измерения моляльности – моль/кг.
Молярная (мольная) доля N – отношение количества растворенного вещества или растворителя к суммарному количеству всех веществ, составляющих раствор:
 ,
, 
где NВ – мольная доля растворенного вещества, NS – мольная доля растворителя, nB – число молей растворенного вещества, nS – число молей растворителя. Мольную долю обычно выражают в долях.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 389; Нарушение авторских прав?; Мы поможем в написании вашей работы!