
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гальванические элементы
|
|
|
|
Н2, Pt | 2Н+, Е0 = 0 В.
Электродный потенциал, измеренный при стандартных условиях (т.е. при температуре 250С и концентрациях веществ, участвующих в электродном процессе, равных 1 моль/л) по отношению к стандартному водородному электроду, называется стандартным электродным потенциалом.
Электродный потенциал металла в условиях, отличающихся от стандартных, рассчитывают согласно уравнению Нернста, которое учитывает зависимость электродного потенциала от концентраций веществ, участвующих в электродных процессах, и температуры:
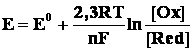
где E – искомый электродный потенциал, E0 – стандартный электродный потенциал, R – газовая постоянная, T – абсолютная температура, F – число Фарадея, n – число электронов, участвующих в электродном процессе, [Ox] и [Red] – концентрации веществ, принимающих участие в соответствующей полуреакции соответственно в окисленной и восстановленной формах.
Перейдя от натуральных логарифмов к десятичным и подставив численные значения F, R и T, получим более удобную для расчетов формулу уравнения Нернста:
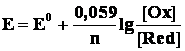
Следует подчеркнуть, что:
1. Уравнение Нернста отдельного электрода условились писать для процесса восстановления независимо от того, в какую сторону сдвинуто равновесие, то есть под знаком логарифма в уравнении Нернста в числителе всегда стоит окисленная форма металла, в знаменателе – восстановленная.
2. Активности твердых веществ в уравнение Нернста не входят. Концентрация твердого вещества принимается равной единице, поэтому в случае металлического электрода уравнение Нернста упрощается:
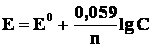
где С – концентрация ионов металла в растворе.
По величине стандартного электродного потенциала металлы принято располагать в ряд напряжений металлов:
| Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb,H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au |
Ряд напряжений характеризует химические свойства металлов:
1. Чем левее расположен металл в ряду напряжений, тем сильнее его восстановительная способность и тем слабее окислительная способность его иона в растворе (т.е. тем легче он отдает электроны (окисляется) и тем труднее его ионы присоединяют обратно электроны (восстанавливаются)).
2. Каждый металл способен вытеснять из растворов солей только те металлы, которые стоят в ряду напряжений правее его, т.е. восстанавливает ионы последующих металлов в электронейтральные атомы, отдавая электроны и сам превращаясь в ионы.
3. Только металлы, стоящие в ряду напряжений левее водорода (Н), способны вытеснять его из растворов кислот (например, Zn, Fe, Pb, но не Сu, Hg, Ag).
В замкнутом гальваническом элементе происходит взаимодействие между металлом и раствором соли другого металла, не соприкасающимися непосредственно друг с другом. Атомы первого металла, отдавая электроны, превращаются в ионы, а ионы второго металла, присоединяя электроны, превращаются в атомы. Первый металл вытесняет второй из раствора его соли. Электрод, на котором протекает окисление, является отрицательным электродом и называется анодом. Электрод, на котором протекает восстановление, является положительным электродом и называется катодом.
Например, при работе гальванического элемента, составленного из цинка и свинца, погруженных соответственно в растворы Zn(NO3)2 и Pb(NO3)2 у электродов происходят следующие процессы: цинк, как более активный металл (согласно ряду напряжений), будет окисляться, а ионы свинца из раствора соли будут восстанавливаться:
Zn – 2ē → Zn2+
Pb2+ + 2ē → Pb.
Суммируя оба процесса, получаем уравнение, выражающее происходящую в гальваническом элементе реакцию в ионной форме:
Zn + Pb2+ → Pb + Zn2+.
Молекулярное уравнение той же реакции будет иметь вид:
Zn + Pb(NO3)2 → Pb + Zn(NO3)2.
Гальванический элемент обозначают схемой. Слева записывается анод Zn|Zn2+, на котором возникает избыток электронов и происходит процесс окисления – отрицательный полюс (–). Справа – катод Pb2+|Pb – электрод с недостатком электронов, положительный полюс (+). Одна вертикальная черта изображает фазовый раздел между металлом и раствором электролита. Двойная вертикальная линия отделяет анодное пространство от катодного. Электроны по внешнему участку цепи, металлическому проводнику, переходят от отрицательного полюса к положительному. Внешнюю цепь на схеме не изображают. В круглых скобках знаками «плюс» и «минус» обозначают полюсы электродов. В рассмотренном примере эта схема будет иметь следующий вид:
(–)Zn|Zn2+||Pb2+|Pb(+) или (–)Zn|Zn(NO3)2||Pb(NO3)2|Pb(+).
Гальванические элементы характеризуются электродвижущей силой (ЭДС), которая равна разности потенциалов двух его электродов. При определении его всегда вычитают из большего потенциала меньший.
Например, электродвижущая сила рассмотренного элемента (при условии, что металлы погружены в растворы, в которых концентрация ионов равна 1 моль/л) равна:
ЭДС = Е(Pb) – Е(Zn) = -0,13 + (-0,76) = 0,63 В
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 619; Нарушение авторских прав?; Мы поможем в написании вашей работы!