
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Коррозия металлов –это процесс самопроизвольного разрушения металлов под действием окружающей среды
|
|
|
|
КОРРОЗИЯ МЕТАЛЛОВ
Для выделения из раствора электролита одного грамм-эквивалента любого вещества нужно пропустить через раствор 96500 кулонов электричества.
При электролизе различных химических соединений равные количества приводят к электрохимическому превращению эквивалентных количеств веществ.
M = k·Q = k·I·t
где m – количество восстановленного или окисленного вещества, I – сила пропускаемого тока, t – время электролиза.
Этот закон вытекает из сущности электролиза. Как уже говорилось, в месте соприкосновения металла с раствором происходит электрохимический процесс – взаимодействие ионов или молекул электролита с электронами металла, так что электрохимическое образование вещества является результатом этого процесса. Ясно, что количество вещества, получающегося у электрода, всегда будет пропорционально числу прошедших по цепи электронов, т.е. количеству электричества.
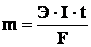
Из второго закона можно вывести следующее следствие:
Исходя из этих законов, можно производить ряд расчетов, связанных с процессом электролиза, например:
1. Вычислять количества веществ, выделяемых или разлагаемых определенным количеством электричества;
2. Находить силу тока по количеству выделившегося вещества и времени, затраченному на его выделение;
3. Устанавливать, сколько времени потребуется для выделения определенного количества вещества при заданной силе тока.
Среда, в которой металл подвергается коррозии, называется коррозионной или агрессивной средой.
Коррозия является окислительно-восстановительным процессом, протекающим на границе двух фаз: металла и коррозионной среды, т.е. это гетерогенный процесс. Разрушение металла начинается с поверхности и проникает глубже.
По характеру коррозионных разрушений различают коррозию сплошную (равномерную) и локальную (неравномерную). Локальные коррозионные повреждения поражают поверхностные слои металла и имеют вид пятен, при распространении их вглубь металла возникают очаги поражения в виде точек.
В зависимости от того, какая часть сплава подвергается коррозии, различают избирательную и межкристаллическую коррозию. При избирательной коррозии разрушению подвергаются зерна только одного компонента сплава, при межкристаллической – межзеренные пограничные участки.
По механизму протекания коррозионного разрушения различают химическую и электрохимическую коррозию.
Химическая коррозия – процесс разрушения металла при взаимодействии с агрессивной средой, это простая химическая реакция окисления металла, не сопровождающееся возникновением электрического тока в системе. Химическая коррозия наблюдается при взаимодействии металлов с агрессивными газами при высокой температуре (газовая коррозия) и с органическими неэлектролитами (коррозия в неэлектролитах).
Газовой коррозии подвергаются режущие инструменты при большой скорости обработки металлов, лопатки газовых турбин, выхлопные патрубки и другие элементы реактивных двигателей, газовая коррозия наблюдается также в электроплавильных печах. Результат газовой коррозии – образование на поверхности металла оксидной пленки. Если пленка прочна, компактна и хорошо сцепляется с поверхностью металла, то она сообщает металлу некоторую пассивность при низкой температуре, т.к. затрудняет доступ кислорода к поверхности металла (такие пленки образуются на поверхности тантала, бериллия, алюминия и др.).
Самый распространенный случай коррозии в неэлектролитах – это коррозия в жидком топливе, например, разрушение цилиндров двигателей внутреннего сгорания. Сами по себе углеводороды не разрушают металлы, коррозионное действие обусловлено примесями, особенно серой и ее соединениями. При сгорании топлива соединения серы превращаются в оксиды серы SO2 и SO3, которые являются коррозионно-активными веществами.
Чаще всего встречается электрохимическая коррозия – это разрушение металла в среде электролита, сопровождающееся возникновением электрического тока в системе. По электрохимическому механизму протекает атмосферная и почвенная коррозия, коррозия в электролитах, коррозия под действием блуждающих токов.
Электрохимическое взаимодействие слагается из анодного окисления и катодного восстановления. Суть электрохимической коррозии составляет процесс анодного растворения металла. В присутствии электропроводной жидкости места контактов металлов, обладающих разными потенциалами (напр., в неоднородных металлических сплавах, на участках изделия, подвергшихся различной термической или механической обработке и т.д.), окажутся подверженными коррозии. На поверхности металлических изделий возникают локальные микрогальванические элементы. Участки с более электроотрицательным потенциалом окажутся анодом и начнут растворяться, а на более электроположительных участках – катодах – будет происходить восстановление, что замедлит или полностью прекратит их собственную коррозию.
Например, при коррозии железа с включениями меди в электролите H2SO4 возникает микрогальванический элемент, который изображается схемой:
Fe|H2SO4|Cu
Железо как более активный металл будет окисляться, на меди будет происходить восстановление ионов водорода:
Fe – 2ē = Fe+2 (процесс на аноде)
2Н+ + 2ē = Н2 (процесс на катоде)
Коррозию металлических изделий можно предотвратить с помощью различных защитных покрытий: неметаллических (лаки, краски, смолы и др.),химических (прочные пленки оксидов, фосфатов и др.), металлических (меднение, лужение, цинкование и др.).
Защитное действие химических и неметаллических пленок обусловлено тем, что они изолируют металл от коррозионной среды.
Металлические покрытия разделяют на анодные и катодные.
Катодное металлическое покрытие – это покрытие металлом, электродный потенциал которого в данных условиях более положителен, чем потенциал защищаемого металла. Например, луженое железо – защитное покрытие железа слоем олова (Е0(олова) = -0,14 В, Е0(железа) = -0,44 В).
Защитная функция покрытия выполняется только до той поры, пока не нарушена целостность покрытия. Будучи нарушенным, катодное покрытие будет ускорять коррозию железа, т.к. возникает микрогальванический элемент, где железо играет роль анода и будет окисляться.
Анодное металлическое покрытие – это покрытие металлом, электродный потенциал которого в данных условиях более отрицателен, чем потенциал защищаемого металла. Например, оцинкованное железо – защитное покрытие железа слоем олова (Е0(цинка) = -0,76 В, Е0(железа) = -0,44 В).
При частичном разрушении анодного покрытия на железном изделии возникает гальванический элемент, где катодом служит железо, а анодом – цинк. В среде электролита цинк будет окисляться, а на железе будет происходить восстановление, а само оно разрушаться не будет. Таким образом, анодное покрытие и в случае его нарушения продолжает играть защитную роль по отношению к основному металлу.
Для торможения коррозионных процессов прибегают к различным способам изменения свойств коррозионной среды: деаэрация и введение ингибиторов коррозии. Деаэрация – освобождение пресной воды и нейтральных солевых сред от растворенного в них кислорода. Деаэрация достигается путем кипячения, дистилляции или барботажем инертным газом.
Ингибиторы коррозии по химическому воздействию делятся на анодные и катодные. Анодные ингибиторы – карбонаты, фосфаты, силикаты щелочных металлов – поляризуют анодные участки и уменьшают количество растворенного металла за счет образования пленки труднорастворимого соединения защищаемого металла. Катодные ингибиторы – соли магния, никеля, цинка – поляризуют катодные участки.
Наиболее эффективные способы защиты от коррозии – электрохимические способы. Электрохимические способы заключаются в том, что защищаемая конструкция искусственно оказывается катодным участком электрохимической системы. Различают катодную и протекторную защиту.
При катодной защите конструкцию искусственно делают катодом путем наложения постоянного тока от внешнего источника. К аноду источника тока присоединяют железный лом, помещенный в ту же среду. Протекторная защита заключается в образовании макрогальванической пары, в которой защищаемый металл играет роль катодного участка, а анодом – протектором – служит более активный металл или сплав (алюминий, магний, цинк, их сплавы). Протекторы наклепывают или соединяют металлическим проводом с защищаемой конструкцией.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 1757; Нарушение авторских прав?; Мы поможем в написании вашей работы!