
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Рассчитать константу равновесия реакции окисления этанола в уксусный альдегид при 310 к
|
|
|
|
1 2 3 4
Рассчитайте тепловой эффект реакции получения газообразного хлороформа при температуре 600К
СН4(г) + 3Сl2(г) = СНСl3(г) + 3НСl(г),
если известны стандартные теплоты образования и средние теплоёмкости участников реакции.
Участники реакции ………………….1 2 3 4
∆H0298, кДж/моль…………………...-75,9 0 -100,4 -92,3
Ср, Дж/(моль. К)…………………17,5 36,7 81,4 26,5
Решение:
∆Н298 х.р., =-100,4-3*(-92,3)-(-74,9)= - 306,4 кДж. моль= - 306,4*103 Дж/моль
∆Ср = 3*26,5 + 81,4 – (17,5 + 3 * 36,7) = 33,3Дж/моль·К
∆Нх.р.,600 = -306,4 * 103 + 33,3 * (600 - 298) = -20544 Дж/моль = -20,5кДж/моль
Решение:
DG0р-ции= - 2,303×R×T×lnКравн;
DG0р-ции= SDG0прод.ре-ции - S DG0исх.в-в;
DG0(С2Н5ОН)= -174 кДж/моль
DG0(СН3СОН)= -139,5 кДж/моль
DG0 ( Н2О)=- - 237 кДж/моль
С2Н5ОН(ж) +1/2О2 Û СН3СНО(р-р) +Н2О(ж);
DG0р-ции=[-139,5+(-237)]-[-174]= - 202,5 кДж/моль
lgKравн=DG0р-ции/2,3×RT; lgKравн = - 202,5×103 Дж/моль/(-2,303 × 8,31 Дж/моль × 310 К)=34,2» 34
Ответ: Kравн=1034,так как Kравн>>103, реакция практически необратима
Определить направление протекания реакции:Н2(Г)+I2(г) Û2НI(Г) при 298 К и С(Н2)=С(I2)=0,01 моль/л; с(НI)=1,0 моль/л. K равн=2
Решение:
DG0р-ции=RT(lnC2(HI)/(c(H2)×c(I2))-ln Kравн)- уравнение изотермы Вант - Гоффа;
DG0р-ции=8,31×298(ln 12/(0,01×0,01)-ln 2)=21091 Дж/моль=21,091 кДж/моль.
Ответ: DG0р-ции>0, поэтому реакция в прямом направлении не может идти самопроизвольно.
Вычислить константу равновесия образования метилового спирта СО(Г)+2Н2(Г)ÛСН3ОН(Г), при стандартных условиях (с.у.) сделать заключение о практической обратимости реакции.
Решение:
DН0обр(СО) = -110 кДж/моль;
DН0обр(СН3ОН)= -239 кДж/моль;
DН0обр(Н2)= 0 кДж/моль;
S0обр(СО)=+198 Дж/моль×К;
S0обр(СН3ОН)= +127 Дж/моль×К;
S0обр(Н2)=+131 Дж/моль×К;
DНр-ции=DН0обр(СН3ОН)-[ DН0обр(СО)+2DН0обр(Н2)]= -239-(-110+0)=
= -129000 Дж/моль;
S0 р-ции= S0обр(СН3ОН)-[ S0обр(СО)+2 S0обр(Н2)]=+127-[198+2*131]=
= -333 Дж/моль×К.
DG0р-ции=DН0-TDS0= -129000-298×(-333)= -29766 Дж/моль
ln Кравн= -DG/RT= 29766/(8,31×298)=12
Кравн= e12 = 1,65×105
Ответ: Кравн= 1,65×105, так как К>103,то реакция при с.у. практически необратима
Во сколько раз изменится скорость прямой реакции 2CO(г) + O2(г) Û2СО2(г) а)при повышении концентрации СО в 3 раза?
б) если уменьшить объем системы в 3 раза?
в) если увеличить давление в 2 раза?
а) v 1= K×C2(CO)×C(O2);
v 2= K×(3C)2(CO)×C(O2);
v 2/ v 1=9.
Ответ: увеличится в 9 раз.
б) v 1= K×C2 (CO)×C (O2);
v 2= K×(3C)2(CO)×3C(O2) = 27К×С2(СО)×С(О2);
v 2/ v 1=27.
Ответ: увеличится в 27 раз.
в) v 1= K×C2(CO)×C(O2);
v 2= K×(2C)2(CO)×2C(O2) = 8К×С2(СО)×С(О2);
v 2/ v 1=8.
Ответ: увеличится в 8 раз.
Во сколько раз следует увеличить давление в системе 2SO2 + O2 Û 2SO3, чтобы скорость прямого процесса возросла в 27 раз?
Решение:
|
v 1 K×C2(SO2)×C(O2)
v2 / v1 = x 3;
x3 = 27;
x = 3.
Ответ: следует увеличить давление в 3 раза.
Константа скорости распада пенициллина при 360С равна 6×10-6 сек -1, а при 410С она равна 1,2×10-5 сек -1. Вычислить температурный коэффициент реакции (g).
Решение:
К2 = К1×g(t1-t2)/10 Þ
g(41-36)/10 = K2/K1 = (1,2×10-5)/(0,6×10-6) = 2;
g1/2 = 2 Þ g = 4.
Ответ: g = 4.
Температурный коэффициент скорости реакции g равен 2,8. Во сколько раз увеличится скорость реакции при повышении температуры от 20 до 750С?
Dt = 75 - 20 = 550C;
v 2/ v 1 = gDt / 10 = 2,8 × 55/10 = 2,8 × 5,5 Þ 287,98,
т.к. lg(v 2/ v 1) = lg 2,8 × 5,5 = 5,5 lg 2,8 = 5,5×0,447 = 2,458,
откуда v 2/ v 1 = 287,98, т.е. скорость возрастет в 288 раз.
Ответ: скорость возрастет в 288 раз.
Константа скорости реакции (СН3СО)2О + Н2О Û 2 СН3СООН при температуре 150С равна 0,0454 мин-1. Исходная концентрация (СН3СО)2О равна 0,5 моль×л-1. Чему будет равна скорость реакции в тот момент, когда концентрация СН3СООН станет равной 0,1 моль×л-1?
Решение:
v = K×C((CH3CO)2O);
из уравнения реакции n((CH3CO)2O): n(CH3COOH) = 1: 2, следовательно,
если С(СН3СООН) = 0,1 моль×л-1, то С (CH3CO)2O) = 0,05 моль×л-1.
А т.к. Сисх((CH3CO)2O) = 0,5 моль×л-1Þ
С (CH3CO)2O) = 0,5 - 0,05 = 0,45 моль×л-1.
v = K×С (CH3CO)2O) = 0,0454×0,45 = 0,0204 моль×л-1×мин-1.
Ответ: в этот момент скорость реакции равна 0,0204 моль×л-1×мин-1.
Во сколько раз увеличится скорость реакции, протекающей при 298 К, если энергию активации Еа уменьшить на 4 кДж/моль?
Решение:
1)Используя уравнение Аррениуса находим отношение констант скоростей реакции 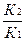 .
. 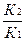 =
=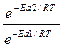 = еЕа1–Еа2
= еЕа1–Еа2
2)Логарифмируем полученное выражение:
3) ln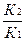 =
= 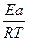 ; ln
; ln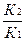 =
= 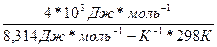 =1,61
=1,61
Находим отношение констант: 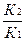 =5,03
=5,03
Ответ: скорость реакции увеличится в 5 раз.
Вычислить температурный коэффициент (γ) константы скорости реакции разложения Н2О2 в температурном интервале 250С–550С при
Еа=75,4 кДж*моль-1.
Решение:
1) Используя уравнение Аррениуса находим отношение 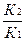 .
.
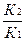 =
=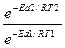 =
= 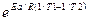
2)Логарифмируем полученное выражение:
ln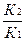 =
=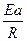 (1/Т1–Т2) или ln
(1/Т1–Т2) или ln 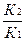 =
= 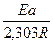
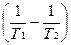
3) Находим логарифм 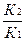
ln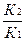 =
= 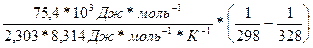 =1,211
=1,211
4) Находим отношение 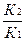 .
.
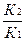 = 101,211=16,2
= 101,211=16,2
5)Используя закон Вант-Гоффа, находим γ.
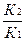 =γ
=γ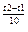 ; γ3=16,2; γ=
; γ3=16,2; γ=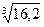 =2,53
=2,53
Ответ: γ=2,53
При лечении онкологических заболеваний в опухоль вводят препарат, содержащий радионуклид иридий – 192. Рассчитайте, какая часть введённого радионуклида останется в опухоли через 10 суток, если период полупревращения равен 74,08 суток.
Решение:
1) Т.к. реакция 1–го порядка, то период полупревращения рассчитывается по формуле: t0,5= 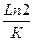
2) Находим константу скорости К=ln2/t0.5 = 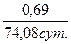 =9,35×10-3сут.-1
=9,35×10-3сут.-1
3) По кинетическому уравнению первого порядка (логарифмическая форма) находим ln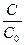
lnС=lnC0–Кt Þ lnC–lnC0=-Кt Þ ln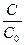 =-Кt Þ
=-Кt Þ
ln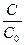 = - 9,35×10-3сут-1×10суток=-9,35×10-2
= - 9,35×10-3сут-1×10суток=-9,35×10-2
4.Находим 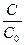 Þ
Þ 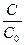 =
=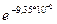 =0,91, т.е. 91%
=0,91, т.е. 91%
Ответ: 91% введённого радионуклида останется в опухоли через 10 суток.
Какая доля (%) новокаина разложиться за 10 суток его хранения при 293 К, если константа скорости гидролиза новокаина при 313К равна 1*10-5сут.-1, а энергия активации (Еа) реакции равна 55,2 кДж/моль.
Решение:
1) По уравнению Аррениуса находим отношение 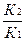
а)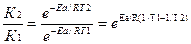
б) Логарифмируем полученное выражение
ln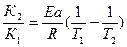
в) Приводим к общему знаменателю для удобства расчётов
ln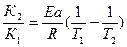 =
=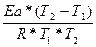
ln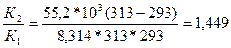
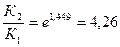
2) Находим константу скорости реакции первого порядка К1
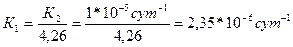
3) По кинетическому уравнению первого порядка находим отношение С/С0
С=С0× е-Kt; 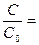 е-Kt = е-2,35×10-6сут × 10сут =0,99998 – осталось препарата неразложившегося.
е-Kt = е-2,35×10-6сут × 10сут =0,99998 – осталось препарата неразложившегося.
4) Находим долю новокаина, разложившегося за 10 суток
W=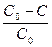 = 1-
= 1-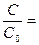 1-0,99998= 2 ×10-5 или 2*10-3 %
1-0,99998= 2 ×10-5 или 2*10-3 %
Ответ: Новокаин практически не разлагается за 10 суток хранения при 293К.
Периоды полупревращения денатурации некоторого вируса равны: при 300С – 5 часов, а при 370С – 1,76 ×10-2часов. Денатурация описывается кинетическим уравнением первого порядка. Вычислите энергию активации процесса.
Решение:
1) Известно, что для реакций первого порядка значение константы К обратно пропорционально t0,5, t0,5=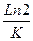 ,поэтому уравнение Аррениуса для двух температур можно представить следующим образом:
,поэтому уравнение Аррениуса для двух температур можно представить следующим образом:
ln τ1(0,5)/ τ2 (0,5) =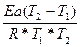 (вывод см. задача №4)
(вывод см. задача №4)
2) Преобразуем это выражение относительно Еа.
Еа= 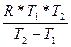 Ln τ1 (0,5)/τ2 (0,5)
Ln τ1 (0,5)/τ2 (0,5)
3) Подставив в это выражение известные по условию задачи величины, получим
Еа= 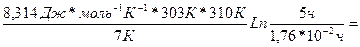 630 213 Дж × моль-1 =
630 213 Дж × моль-1 =
=630,2кДж × моль-1
Ответ: Еа= 630,2кДж × моль-1
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 8195; Нарушение авторских прав?; Мы поможем в написании вашей работы!