
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Газообразное состояние вещества. Законы идеальных газов. Реальные газы
|
|
|
|
Газы распространены в природе и находят широкое применение в технике. Их используют в качестве топлива, теплоносителей, сырья для химической промышленности, рабочего тела для выполнения механической работы (газовые турбины); газы являются физической средой для осуществления, газового разряда в трубках, их используют при сварке и резке металлов, при газовой химико-термической обработке металлических поверхностей, в некоторых биохимических процессах и т.д.
В технике находят применение свыше 30 различных газов. Особенно часто употребляемым является природный газ – почти чистый метан, а также воздух, представляющий смесь газов (в основном, азота и кислорода).
В физике, в физической химии и термодинамике часто употребляют термины «идеальный» и «реальный» газы. Идеальным называется газ, находящийся в таких условиях, при которых можно пренебречь силами взаимодействия между молекулами и собственным объемом молекул, который чрезвычайно мал по сравнению с общим объемом газа.
Существующий в природе газ называется реальным. Молекулы реальных газов обладают (хотя и очень малым) собственным объемом, который наряду с проявляющимися межмолекулярными силами сцепления и отталкивания необходимо учитывать при различного рода расчетах.
С повышением температуры газа расстояния между молекулами увеличиваются, в молекулярные силы взаимодействия ослабевают. При этом свойства реального газа приближается к свойствам идеального газа. Таким образом, идеальный газ является предельным состоянием любого вещества (твердого, жидкого и газообразного) при достаточно высокой температуре и низком давлении.
Физическое состояние газа определяется тремя параметрами: давлением(р),объемом (V) и температурой (Т). Эти величины связаны уравнением, получившим название уравнения состояния идеального газа или уравнения Клапейрона-Менделеева. Частная форма этого уравнения была дана французским ученым Б. Клапейроном (1834), а более удобный вариант уравнения состояния идеального газа предложил Д. И. Менделеев (1874):
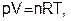
 (3.1)
(3.1)
где р – давление газа, Па;
V – объем газа, м3;
n – число молей газа;
R – молярная газовая постоянная, Дж/(мольК);
Т – абсолютная температура, К.
Число молей газа вычисляют, зная массу его m (г) и молярную массу:
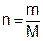 . (3.2)
. (3.2)
Абсолютной называется температура, выраженная в градусах термодинамической температурной шкалы. Нуль этой шкалы находится на 273,15 0С ниже нуля Международной практической шкалы и называется абсолютным нулем. Температуры по обеим шкалам могут быть выражены, соответственно, в градусах Кельвина (Т, К) и в градусах Цельсия (t, 0С). В расчетах пользуются простым соотношением:
Т = t + 273,15 (3.3)
Численное значение молярной газовой постоянной находят из уравнения (3.1), подставляя величину параметров для 1 моля газа, находящегося при нормальных условиях (t = 0 0С, р =101325 Па, V = 22,4 м3): R = 8,314 Дж/(мольК). Молярная газовая постоянная R имеет размерность энергии (работы), отнесенной к молю идеального газа при нагревании его на 1 градус.
Заменив n в уравнении (3.1), получим развернутую формулу уравнения состояния идеального газа:
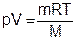 . (3.4)
. (3.4)
Уравнение состояния идеального газа широко применяется для вычисления параметров состояния газов (р, v или Т), а также при опытном определении молекулярных масс газообразных (парообразных) веществ на основе измерения m, р; V и Т газа (или пара).
Закон Бойля-Мариотта (1662):объем данной массы идеального газа при постоянной температуре изменяется обратно пропорционально давлению, под которым газ находится.
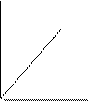
Аналитическое выражение закона имеет вид: при Т = сonst р1V1 = р2V2 или рV = const, т.е. произведение давления на объем данной массы газа есть величина постоянная при постоянной температуре. Константа в уравнении зависит от природы газа, его количества и температуры, но не зависит ни от объема, ни от давления. Графически закон Бойля-Мариотта изображается в виде изотермы (рис. 2 (а)).
Закон Гей-Люссака (1802):для данной массы идеального газа при постоянном давлении объем прямо пропорционален давлению.
Аналитическое выражение закона имеет вид: при р = сonst Т1V2 = Т2V1 или Т/V = const. Графически закон Гей-Люссака изображается в виде изобары (рис. 2 (б)).
Закон Шарля (1787):для данной массы идеального газа при постоянном объеме температура прямо пропорциональна давлению.
Аналитическое выражение закона имеет вид: при V = сonst Т1р2 = Т2р1 или Т/р = const. Графически закон Шарля изображается в виде изохоры (рис. 2 (в)).
Закон Авогадро (1811):в равных объемах различных газов при постоянной температуре находится одинаковое число частиц. Отсюда вытекают следствия: один моль любого газа содержит 6,025.1023 молекул и при нормальных условиях 1 моль газа занимает объем 22,4 дм3.
Законы идеальных газов не применяют для реальных газов, поскольку в реальных газах нельзя пренебречь силами взаимодействия между молекулами и объемом их молекул.
Т = сonst р = сonst V = сonst
р V р
 |  | ||||||||
 | |||||||||
 | |||||||||
 | |||||||||
V Т Т
Рис. 2. Графическое изображение газовых законов:
а – изотерма, б - изобара, в – изохора идеального газа
Поведение реальных газов при средних давлениях характеризует уравнение состояния, предложенное голландским ученым Ван-дер-Ваальсом (1873). В уравнение состояния для 1 кмоля идеального газа (3.1) Ван-дер-Ваальс ввел две поправки: p¢ (величина, характеризующая силы межмолекулярного притяжения или внутреннее давление газа) и b (поправка на собственный объем молекул газа).
Поскольку силы притяжения действуют в одном и том же направлении с внешним давлением и стремятся как бы дополнительно сжать газ, то поправка p¢ в уравнении имеет знак «плюс». Было установлено, что силы межмолекулярного притяжения возрастают прямо пропорционально квадрату плотности газа или обратно пропорционально квадрату его объема:
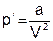 (3.5)
(3.5)
где a – коэффициент пропорциональности, учитывающий способность молекул данного вещества к взаимному притяжению (зависит от природы газа).
Величину объема самих молекул необходимо вычесть из общего объема газа. Поправка b равна учетверенному объему молекул и представляет собой тот предельный объем, до которого можно сжимать газ. Дальнейшее сближение молекул невозможно, так как этому начинают препятствовать возникающие огромные силы электростатического отталкивания. Таким образом, b учитывает как собственный объем молекул, так и силы отталкивания между ними при малых расстояниях. Для 1 кмоля газа
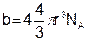 (3.6)
(3.6)
где 4/3pr3 – объем одной молекулы (для шарообразной формы); NА – постоянная Авогадро. Итак, с учетом поправок уравнение состояния реального газа имеет вид
(p + p¢)(V – b) = RT или (3.7)
(p + 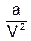 )(V –
)(V – 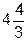 pr3NА) = RT (3.8)
pr3NА) = RT (3.8)
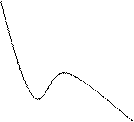
Это уравнение отражает состояние реального газа наиболее точно в области средних давлений. Изотерма реального газа для низких температур изображена на рис. 3. На изотерме можно выделить три участка: AB, BC, CD.На участке ABмалым изменениям объема V соответствуют большие изменения давления p. Это качественно характеризует жидкое состояние. На участке CD между объемом и давлением существует обратно пропорциональная зависимость, что характерно для газообразного состояния. Участок BC отвечает переходу газа в жидкость или жидкости в газ (пар). На опытных изотермах этот участок выражается прямой линией, параллельной оси объемов. S-образная часть кривой рассчитана по уравнению (3.8) и характеризует состояния вещества, большей частью нереализуемые на опыте.
 P A
P A

 B C
B C
D
 V
V
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 1944; Нарушение авторских прав?; Мы поможем в написании вашей работы!