
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Характеристики некоторых веществ
|
|
|
|
Таблица 3.
| Вещество | Вид кристалла | Энергия кристаллической решетки, кДж/моль | Температура плавления, °С | Электрическая проводимость при 298 К, См.м-1 |
| СН4 | Молекулярный | 10,0 | -182 | - |
| НСI | Молекулярный | 21,3 | -112 | - |
| Н2О | Молекулярный | 50,2 | - | |
| С (алмаз) | Атомно-ковалентный | 1.10-13 | ||
| Ge | Атомно-ковалентный | 1-2 | ||
| NaCl | Ионная | 1.10-15 | ||
| Na | Металлический | 108,3 | 2,4.107 | |
| Al | Металлический | 3,8.107 | ||
| Zn | Металлический | 1,7.107 | ||
| Mo | Металлический | 1,3.107 |
Аморфные вещества не имеют упорядоченной структуры. Такие вещества изотропны – их свойства совершенно одинаковы по всем направлениям внутри тела. Эти вещества не имеют постоянной температуры плавления. При нагревании они сначала размягчаются в определенном интервале температур, а затем постепенно переходят в жидкотекучее состояние. При охлаждении эти расплавы вновь переходят в твердое состояние без образования кристаллической структуры. Аморфные вещества по структуре аналогичны жидкостям и отличаются от них лишь очень малой подвижностью своих частиц. Поэтому аморфные вещества рассматривают как переохлажденные жидкости с высокой аномальной вязкостью. Некоторые из них очень медленно текут (стекло толще внизу). К аморфным веществам относят многие полимеры, смолы, простые вещества (Si, Se, Ag и др.), оксиды (SiO2, B2O3 и т.д.).
Резко противопоставлять аморфные тела кристаллическим не следует, так как многие вещества можно получить как в аморфном, так и кристаллическом состоянии. Например, SiO2 как горный хрусталь – это кристалл, а как опал – аморфное тело.
Аморфные тела могут переходить в кристаллическое состояние с течением времени. Это связано с тем, что с энергетической точки зрения аморфные вещества по сравнению с кристаллическими обладают большим запасом энергии, так как при кристаллизации твердого вещества происходит заметное выделение тепла, а при застывании расплавленного аморфного вещества никакого выделения тепла не наблюдается. Поскольку аморфное состояние вещества является энергетически менее устойчивым, возникает тенденция к переходу вещества из аморфного состояния в кристаллическое. Этот процесс является длительным во времени. Для перехода стекла в кристаллическое состояние необходимо время в сто и более лет. При этом стекло мутнеет. В процессе кристаллизации внутреннее напряжение в стекле может настолько увеличиться, что оно разрушается без видимых внешних причин.
3.5. Типы кристаллических решёток
По природе частиц в узлах кристаллической решетки и химических связях между ними можно все кристаллы разделить на молекулярные, атомно-ковалентные, ионные и металлические. Кроме того, существуют кристаллы со смешанными химическими связями.
Молекулярные кристаллы (Аr, О2, N2, СО2, Н2О). В узлах решеток находятся молекулы, между которыми действуют вандерваальсовы и водородные силы, имеющие невысокую энергию. Это и определяет свойства молекулярных кристаллов: невысокую энергию связей, низкую температуру плавления, по механическим свойствам они мягкие и являются диэлектриками. Вещества с молекулами сферической формы имеют структуру плотной упаковки. Кристаллы с полярными молекулами в узлах имеют более высокую прочность и температуру плавления, чем кристаллы с неполярными молекулами в узлах. Значительное упрочнение кристаллов обусловливают водородные связи, например, кристаллов льда. Из-за направленности водородных связей координационное число и плотность упаковки кристаллов снижаются (табл. 3). Например, координационное число воды в кристаллах льда равно четырем и, соответственно, плотность льда относительно невысока (меньше плотности жидкой воды).
Атомно-ковалентные кристаллы (C, Ge, Si, SiO2, SiC). В узлах кристаллов располагаются атомы, образующие друг с другом прочные ковалентные связи. Это обусловливает высокую энергию решетки, температуру плавления, они очень твердые, могут быть и диэлектриками и полупроводниками. Из-за направленности ковалентных связей координационные числа и плотность упаковки в атомно-ковалентных кристаллах обычно невелики. Так, например, в кристалле алмаза углерод имеет sp3-гибридизацию и, соответственно, координационное число 4 (рис. 4).
Ионные кристаллы (KCl, CaF2, Na2CO3). Структурными единицами кристаллов этого типа являются положительно и отрицательно заряженные ионы, между которыми происходит электростатическое взаимодействие, характеризуемое достаточно высокой энергией. Этим объясняются свойства веществ с ионными кристаллами: высокая температура плавления, такие вещества твердые и хрупкие, являются диэлектриками. Из-за ненаправленности и ненасыщенности связей и сферической формы частиц координационные числа у ионов могут быть высокими, как, например, в решетках NаС1 (рис. 5) и КС1. У соединений со сложными ионами форма кристаллической решетки искажается.
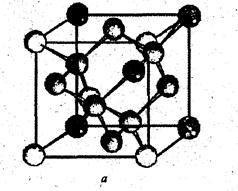 | 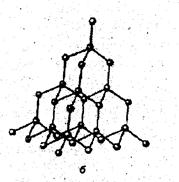 | ||
Рис. 4. Структура алмаза: а – решетка;
б – схема направлений химических связей
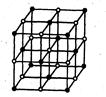 |  | ||
Рис. 5. Кристаллическая структура хлорида натрия
и упаковка сферических ионов: большие шары – С1-;
шары меньших размеров – Nа+.
Металлические кристаллы и связь (К, Са, Zn, Ni). Большинство элементов периодической таблицы Д. И. Менделеева относятся к металлам, которые характеризуются рядом особых свойств: высокой электрической проводимостью, высокой теплопроводностью, ковкостью и пластичностью, металлическим блеском и высокой отражательной способностью по отношению к свету. Эти специфические свойства металлов можно объяснить особым типом химической связи, получившей название металлической.
У большинства металлов на внешней электронной оболочке имеется значительное число вакантных орбиталей и малое число электронов. Поэтому энергетически более выгодно, чтобы электроны не были локализованы, а принадлежали всему металлу. Согласно теории свободных электронов в узлах решетки металла находятся положительно заряженные ионы, которые погружены в электронный «газ», распределенный по всему металлу. Таким образом, валентные электроны у металлов не локализованы. Между положительно заряженными ионами металла и нелокализованными электронами существует электростатическое взаимодействие, обеспечивающее устойчивость вещества.
Энергия этого взаимодействия является промежуточной между энергиями ковалентных и молекулярных кристаллов. Поэтому элементы с чисто металлической связью (s и p-металлы) характеризуются относительно невысокими температурами плавления и твердостью. Наличие электронов, которые могут свободно перемещаться по объему кристалла, обеспечивает высокие электрическую проводимость и теплопроводность, а также ковкость и пластичность металлов. Металлический блеск обусловлен отражением световых лучей от электронного газа, который несколько выходит за границу положительно заряженных ионов. Из-за ненаправленности связей, сферической формы и одинакового размера ионов металлы кристаллизируются, как правило, в плотноупакованные гексагональные или кубические гранецентрованные структуры.
Кристаллы со смешанными связями. Тот или иной вид химической связи или взаимодействия в чистом виде в кристаллах встречается редко. Обычно между частицами существуют сложные взаимодействия, которые можно описать наложением двух или более видов связей друг на друга. Например, в некоторых молекулярных кристаллах (H2O, Н2О2, НF) наряду с вандерваальсовыми силами возникают водородные связи, которые значительно упрочняют кристаллы. Ионная связь в чистом виде практически не существует, так как между частицами в ионных кристаллах также действует ковалентная связь, поэтому можно лишь говорить о той или иной степени ионности, которая возрастает с увеличением разности ЭО частиц в кристаллах. У d- и f-металлов наряду с нелокализованной металлической связью могут действовать также локализованные ковалентные связи между соседними атомами, имеющими неспаренные d- и f-электроны. В этих случаях возрастает энергия кристаллов, температура плавления и прочность металлов. В атомных кристаллах наряду с ковалентной связью могут существовать вандерваальсовы силы, например у одной из аллотропных модификаций углерода – графита.
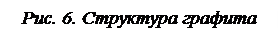
При образовании кристаллов графита у углерода происходит sp2-гибридизация с образованием двумерных (плоских) структур, у которых валентные углы связей равны 120° (рис. 6). Длина связи С-С в плоскости равна 0,142 нм. Четвертый валентный электрон (p-электрон) каждого атома вступает в p-связь между соседними атомами. Эти p-электроны очень подвижны и обеспечивают электронную проводимость. Между плоскими слоями графита возникает слабое вандерваальсово взаимодействие, длина связи составляет 0,35 нм.
Прочные ковалентные связи (716 кДж/моль) обеспечивают графиту высокую температуру плавления и химическую стойкость, наличие подвижных электронов p-связи – электрическую проводимость и теплопроводность. Из-за слабых вандерваальсовых сил (энергия связи 17 кДж/молъ) между слоями графит очень мягок, легко расслаивается, что позволяет использовать его как смазку и как наполнитель стержней карандашей.
Вследствие большого расстояния между плоскостями и низкой энергии связи между плоскостями графита могут внедряться атомы других элементов, например фтор или щелочные металлы, ионы или молекулы, например IС1, FеС13. В результате получаются соединения графита, например С6Li, С8К, СFx, СxIСly. Такие соединения называются интеркалятами или слоистыми соединениями. Процесс вхождения молекул, ионов или атомов в решетку называется интеркалированием:
C + xF = CFx
Интеркалирование характерно не только для графита, но и для многих других простых веществ и соединений, например ТiS2, V3О5, МпО2. При включении атомов, ионов или молекул в графит изменяются межплоскостные расстояния кристалла графита и его свойства. Например, электрическая проводимость некоторых интеркалятов графита приближается к проводимости металлов, а иногда и ее превосходит. Интеркиляты уже находят применение для изготовления проводов, соединения графита со фтором и литием. Используются в качестве электродов новых энергоёмких химических источников тока.
Слоистые соединения являются разновидностью особого класса соединений, называемых клатратами или соединениями включения, которые образованы включением молекул («гостей») в полости кристаллического каркаса, состоящего из частиц другого вида («хозяев»), Кроме слоистых соединений (интеркалятов), к клатратам относятся газовые гидраты, клатраты мочевины и др.
В газовых гидратах в полостях кристаллов льда могут находиться молекулы, размеры которых лежат в пределах 0,38 ÷ 0,92 нм (N2, О2, СгН4, С02, Сl2, Аг, Хе, Н2S, СH4, Вг2 иди др.). Например, известны клатраты примерного состава СН4.6Н2О, в которых на 46 молекул воды имеется 8 полостей, занятых молекулами метана.
По теории Л. Полинга образование газовых гидратов в жидкости мозга является причиной анестезии, например ксеноном. Клатраты существуют в природе. Например, на значительной глубине в земле в районах вечной мерзлоты существуют твердые клатраты метана. Это источник ценного сырья, с другой стороны - это пополнение парниковых газов за счет метана при таянии клатратов. Оценки показывают, что запасы углеводородного сырья в газовых гидратах заметно превышают запасы топлива на Земле во всех других видах. Клатраты используются для разделения газов, особенно благородных,опреснения морской воды. При подаче пропана под давлением образуются твёрдые газовые клатраты, после их отделения и нагревания получают чистую воду и пропан, который снова используется в процессе. Процесс опреснения можно выразить с помощью следующих уравнения:
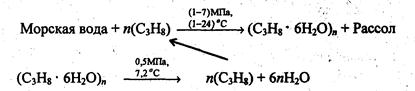
В то же время образование газовых гидратов доставляет большие неприятности работникам нефтяной и газовой промышленности, поскольку они могут забивать трубопроводы и аппаратуру.
Таким образом, твердые вещества могут находиться в аморфном и кристаллическом состояниях. Носителем свойств твердых тел является фаза. Существует 14 типов кристаллических решеток. Свойства кристаллических систем, прежде всего, определяются типом химических связей и взаимодействием частиц. В большинстве случаев в кристаллах существует несколько видов связи между частицами.
Вопросы для самоконтроля:
1. В чем заключается характеристика четырех агрегатных состояний вещества?
2. Что такое идеальный газ?
3. Какие параметры описывают состояние идеального газа? Написать уравнение Клапейрона–Менделеева.
4. В чем заключается закон Бойля-Мариотта?
5. В чем заключается закон Гей-Люссака?
6. В чем заключается закон Шарля?
7. В чем заключается закон Авогадро.
8. Каковы свойства реальных газов и уравнение Ван-дер-Ваальса, описывающие их?
9. Каковы особенности жидкого состояния вещества?
10. Каковы свойства жидкостей?
11. Каковы свойства жидких кристаллов?
12. Каковы основные свойства твердых тел?
13. Каковы особенности аморфного состояния вещества?
14. Каковы особенности кристаллического состояния вещества?
15. Каковы особенности молекулярного типа кристаллической решетки?
16. Каковы особенности атомно-ковалентного типа кристаллической решетки?
17. Каковы особенности ионного типа кристаллической решетки?
18. Каковы особенности металлического типа кристаллической решетки?
19. В чем состоят особенности кристаллов со смешанными связями?
20. Каковы свойства плазменного состояния?
Вопросы для самостоятельной работы:
1. Законы идеальных газов (уравнение состояния идеального газа, законы Бойля-Мариотта, Гей-Люссака, Шарля, Авогадро, Дальтона).
2. Свойства реальных газов.
3. Уравнение Ван-дер-Ваальса.
4. Типы кристаллических решеток: молекулярной, атомно-ковалентной, ионной, металлической и смешанному типу
Литература:
1. Семенова Е. В., Кострова В. Н., Федюкина У. В. Химия. – Воронеж: Научная книга – 2006, 284 с.
2. Коровин Н.В. Общая химия. - М.: Высш. шк. – 1990, 560 с.
3. Глинка Н.Л. Общая химия. – М.: Высш. шк. – 1983, 650 с.
4. Глинка Н.Л. Сборник задач и упражнений по общей химии. – М.: Высш. шк. – 1983, 230 с.
5. Ахметов Н.С. Общая и неорганическая химия. М.:Высшая шк. – 2003, 743 с.
6. Угай Я.А. Общая и неорганическая химия. - М.: Высш. шк. – 1997, 550 с.
Лекции 5-6 (4 ч)
Тема 4. Энергетика химических процессов
Цель лекции: рассмотреть общие понятия термодинамики, дать характеристику термодинамическим функциям состояния и процесса; сформулировать первый закон (начало) термодинамики, охарактеризовать внутреннюю энергию системы, энтальпию системы; рассмотреть тепловые эффекты химических реакций, закон Гесса и следствия из него как основной закон термохимии; сформулировать второй закон (начало) термодинамики; рассмотреть принцип работы тепловой машины, КПД системы; дать характеристику свободной и связанной энергии, энтропии системы; рассмотреть энергию Гиббса и Гельмгольца, как критерий направленности химических реакций.
Изучаемые вопросы:
4.1. Общие понятия термодинамики.
4.2. Первый закон (начало) термодинамики. Внутренняя энергия системы. Энтальпия системы.
4.3. Термохимия. Тепловые эффекты химических реакций.
4.4. Закон Гесса и следствия из него.
4.5. Основные формулировки второго закона (начала) термодинамики.
4.6. Принцип работы тепловой машины. КПД системы.
4.7. Свободная и связанная энергии. Энтропия системы.
4.8. Энергия Гиббса, энергия Гельмгольца и направленность химических реакций.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 537; Нарушение авторских прав?; Мы поможем в написании вашей работы!