
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Факторы, влияющие на скорость химических реакций. Закон действующих масс
|
|
|
|
На скорость химических реакций оказывают влияние следующие факторы: природа и концентрации реагирующих веществ; температура, природа растворителя, присутствие катализатора и т.д.
Зависимость скорости химических реакций от концентрации устанавливает закон действующих (действия) масс, сформулированный Гульдбергом и Вааге (1867), этот закон и является основным законом кинетики: скорость химической реакции при постоянной температуре пропорциональна произведению концентраций реагирующих веществ, взятых в степени стехиометрического коэффициента данного вещества в уравнении реакции.
Для гомогенной реакции общего вида
аA + вB → сC + d D
uпр = k1CАа CВв, (5.4)
uобр = k2Cсс CD d, (5.5)
где uпр – скорость прямой реакции;
uобр – скорость обратной реакции;
СА,CB,CC и CD – концентрации реагирующих веществ, например, моль/дм3;
а, в, с, и d – стехиометрические коэффициенты участников реакции;
k1 и k2 – коэффициенты пропорциональности, названные константой скорости химической реакции.
Для газов вместо концентрации можно использовать давления
uпр = k1РАа РВв.
Определим физический смысл константы скорости. Примем концентрации веществ А и В равными 1 моль/дм3 (СА = CB = 1 моль/дм3), тогда uпр = k1. Таким образом, константа скорости – это скорость реакции, если концентрации реагирующих веществ равны 1 моль/дм3. Константа скорости зависит от тех же факторов, что и скорость, за исключением концентрации веществ. Причем, чем больше величина константы скорости, тем больше скорость процесса. Константу скорости можно найти опытным путем или посчитать, используя уравнения, описывающие механизм химической реакции.
Зависимость константы скорости (и скорости) процесса от температуры определяет приближенное правило Вант-Гоффа: увеличение температуры на каждые 10 ОС увеличивает скорость процесса в 2 - 4 раза.
Аналитическое выражение этого правила в общем виде:
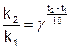 (5.6)
(5.6)
где k1 и k2 – константы скорости при температуре t1 и t2,
γ – температурный коэффициент Вант-Гоффа (γ = 2 ¸ 4).
Правило Вант-Гоффа применяют при изменении температуры ниже 30 ºС. При более высоких изменениях температуры используют уравнение Аррениуса
lnk = B – 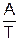 , (5.7)
, (5.7)
где А и В – постоянные величины для данной реакции.
Скорость гетерогенных реакций имеет ряд особенностей. Гетерогенные реакции идут на поверхности раздела фаз, которая и служит реакционным пространством (поверхностью). Поэтому первой особенностью кинетики этих реакций является влияние площади реакционной поверхности на скорость реакции. Вместо концентрации твердой фазы в уравнение вводят площадь поверхности этого вещества (S)
uпр = k1CАа SВ (5.8)
Второй особенностью гетерогенных процессов является зависимость скорости реакции от скорости подвода реагента в зону химической реакции, то есть, от скорости диффузии реагентов. Скорость диффузии увеличивают перемешиванием реакционной среды.
Скорость гетерогенной обратимой реакции определяется разностью скоростей прямой и обратной реакции (uреакции = uпр - uобр) – это третья особенность гетерогенных процессов.
5.3. Классификация химических реакций по молекулярности и по порядку
Все кинетические реакции различают по молекулярности и по порядку реакции. Молекулярность реакции определяется числом молекул, участвующих в элементарном акте химического взаимодействия. По этому признаку реакции разделяют на мономолекулярные, бимолекулярные и тримолекулярные.
Мономолекулярными называют такие реакции, в которых в элементарном акте взаимодействия участвует одна молекула, например, реакция разложения:
I2 = 2I.
Cюда же относятся реакции радиоактивного и изомерного превращения сложных молекул в газах и растворах.
Бимолекулярными называют реакции, в которых в элементарном акте взаимодействия встречаются две молекулы. Например, реакция образования йодистого водорода
H2 + I2 = 2HI
или в общем виде
А + В = D.
К этому типу относятся также реакции этерификации сложных эфиров и многие другие.
Тримолекулярными называются реакции, в которых в элементарном акте взаимодействия участвуют три молекулы. Например,
2NO + O2 = 2NO2
Необходимым условием любой химической реакции является одновременное столкновение молекул реагирующих веществ. В реакционном сосуде при огромном числе молекул и хаотичности их движения вероятность столкновения более трех молекул ничтожно мала. Реакция с молекулярностью более трех неизвестна. В тех случаях, когда из химического уравнения следует, что в реакции участвует большее число молекул, процесс на самом деле проходит более сложным путем.
Сложные реакции классифицируют по порядку, то есть, по сумме стехиометрических коэффициентов при концентрации реагирующих веществ. В простейшем случае порядок и молекулярность совпадают. Например, для реакции окисления NO до NO2 порядок и молекулярность совпадает и равны трем. Если u = k 1СNO2СO2, то порядок равен n = 2 + 1= 3. В сложных процессах порядок и молекулярность не совпадают, поскольку стехиометрическое уравнение описывает процесс в целом и не отражает истинного механизма реакции, протекающей через определенные стадии. Сложные реакции описываются кинетическим уравнением, содержащим несколько констант скоростей. К сложным реакциям относятся обратимые, параллельные, последовательные, сопряженные, цепные и другие реакции. Теория всех этих реакций основана на положении, что при протекании в системе нескольких реакций каждая из них проходит самостоятельно и к каждой из них применены уравнения кинетики простых реакций.
Параллельными реакциями называют реакции, которые имеют вид
А& В + Д
(С + К, т. е. при которых одни и те же исходные вещества, одновременно реагируя, образуют разные реакции. Например, при разложении бертолетовой соли возможны процессы
6КСlО3 ® 2КСl + О2
(3КСlО4 + КCl.
Последовательными называют реакции, которые протекают через ряд последовательных стадий по схеме
А → В→ С→ D…
Примером служит гидролиз полисахаридов до моносахаридов.
Сопряженными называют реакции, протекающие по схеме:
1) А + В → М
2) А + С → N
Реакция 1) может протекать самостоятельно, а реакция 2) только при наличии реакции 1). Например, йодоводород окисляется пероксидом водорода только при окислении сульфата железа пероксидом водорода. Побочный процесс называют химической индукцией, вещество А – актором, В – акцептором, С – индуктором.
Обратимыми называют реакции, скорость которых равна разности между прямой и обратной реакцией
uреакции = uпр - uобр
Например, образование сложного эфира.
Цепные реакции протекают путем образования цепи следующих друг за другом реакций, в которых участвуют активные частицы с насыщенными свободными валентностями – так называемыми свободными радикалами.
В целом скорость сложного процесса зависит от скорости самой медленной стадии, которую называют лимитирующей. Чаще всего, по какому механизму протекает самая медленная стадия, таков и механизм процесса в целом. Порядок реакции меняется от 0 до 3 и может быть так целым, так и дробным числом.
Скорость реакции нулевого порядка (u = k) зависит от природы реагирующих веществ, например, омыление сложного эфира. Скорость реакции первого порядка (u = kСА) зависит от природы реагирующих веществ и концентрации одного из реагирующих веществ, например, гидролиз сахарозы зависит только от изменения концентрации сахарозы. Скорость реакции второго порядка (u = kСАСВ или u = kСА2) зависит от концентрации двух реагентов, например, йодирование ацетона.
Таким образом, молекулярность характеризует элементарный механизм отдельных стадий сложного процесса, а порядок реакции характеризует формально-кинетическую зависимость скорости реакции от концентрации реагирующих веществ.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 631; Нарушение авторских прав?; Мы поможем в написании вашей работы!