
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Поле интегрирования
|
|
|
|
Откуда
Кинетические уравнения реакци первого и второго порядка
К реакциям первого порядка относятся такие, которые описывают уравнением вида u = kС или
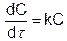 (5.9)
(5.9)
Если обозначить через а – начальную концентрацию вещества до реакции, а через (а – х) концентрацию вещества в момент времени t от начала реакции и х – количество прореагировавшего вещества, то
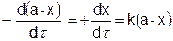
или
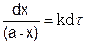 (5.10)
(5.10)
Интегрируя уравнение, получим
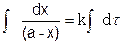
- ln(а – х) = kt + const, (5.11)
где const – постоянная интегрирования, которая определяется из условия, что в начале опыта t = 0 и x = 0. Подставив эти значения в уравнение (5.11), найдем: const = - ln a. Подставляя эту величину в уравнение (5.11), получим:
- ln(а – х) = kt - lnа, (5.12)
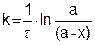 или
или 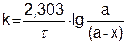 (5.13)
(5.13)
Это уравнение дает возможность вычислить концентрацию реагирующего вещества в любой момент времени по известной величине константы скорости, или найти константу скорости реакции при заданной температуре путем определения концентрации в любой момент времени.
Из уравнения (5.13) следует, что размерность константы скорости реакции первого порядка будет t-1 (например, мин-1 или с -1).
Скорость реакции первого порядка не зависит от объема (разбавления), в котором протекает реакция. Иными словами, в единицу времени превращению подвергается одна и та же часть вещества.
Наряду с константой скорости, реакции характеризуют периодом полураспада (t1/2) – временем, за которое прореагировало половина вещества:
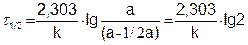 (5.14)
(5.14)
Из уравнения (5.14) следует, что константа скорости реакции первого порядка обратно пропорциональна периоду полураспада.
По закону реакций первого порядка протекают в основном физические процессы: диффузия, растворение, радиоактивный распад; и некоторые химические реакции: гидролиз полисахаридов и т.д.
К реакциям второго порядка относятся реакции соединения типа А + В → С или обмена А + В → С + D, а так же реакции разложения и др. Скорость реакции второго порядка определяется уравнением:
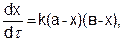 (5.15)
(5.15)
где k – константа скорости, a и b – число молей веществ А и В в начальный момент времени, х – число прореагировавших молей.
Здесь возможны два случая. Первый случай, когда вещества а и b вступают в реакцию в эквивалентных количествах (a = в) и второй, когда (a ≠ в). Рассмотрим оба случая.
Первый случай (a = в). Уравнение (5.15) принимает вид
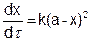 (5.16)
(5.16)
Разделяя переменные и проводя интегрирование, получим
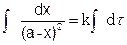 (5.17)
(5.17)
Откуда
1/(а – х) = kt + const. (5.18)
При t = 0, x = 0
const = 1/а (5.19)
Подставив уравнения (5.19) в (5.18), получим
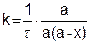 (5.20)
(5.20)
Размерность константы скорости реакции первого порядка [мин-1(моль/дм3)-1]. В данном случае скорость реакции зависит от разбавления раствора или его концентрации.
Второй случай (a ≠ в). Если для реакции взяты неэквивалентные количества реагирующих веществ, то
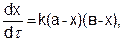 (5.21)
(5.21)
После разделения переменных получим это уравнение в другом виде:
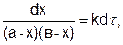 (5.22)
(5.22)
Выражение, стоящее в левой части уравнение (5.22), можно представить как
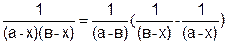 .
.
После подстановки этого выражения в уравнение (5.22) получим
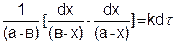 (5.23)
(5.23)
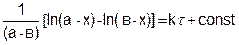 (5.24)
(5.24)
Поскольку при t = 0, x = 0, постоянная интегрирования равна
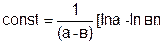 (5.25)
(5.25)
Таким образом, подставляя это выражение в уравнение (5.24), найдем
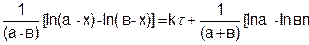
Откуда
k = 1/t • 2,303/(а – в)[ln(в(а – х)/а(в – х)] (5.26)
Это и есть кинетическое уравнение реакции второго порядка при условии (a ≠ в).
Определить, какого порядка данная реакция можно, используя метод подстановки. Для этого из реакционной смеси отбирают пробы через определенный промежуток времени и анализируют на содержание исходных веществ. Затем полученные значения подставляют в кинетические уравнения первого или второго порядка. И тем уравнением, где константа скорости в ходе процесса не меняется, определяется и порядок реакции.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 304; Нарушение авторских прав?; Мы поможем в написании вашей работы!