
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория активизации молекул. Уравнение Аррениуса
|
|
|
|
Скорость любой химической реакции зависит от числа столкновений реагирующих молекул, так как число столкновения пропорционально концентрациям реагирующих веществ. Однако не все столкновения молекул приводят к акту их взаимодействия, а повышение температуры на 10 0С приводит к увеличению скорости в 2-4 раза, в то время как число столкновений увеличивается всего на 2 %.
Очевидно, что скорость реакции зависит не только от числа столкновений, но и от каких-то свойств сталкивающихся молекул. Это явление находит объяснение в теории активации С. Аррениуса (1889). Согласно этой теории, реакционноспособны только те молекулы, которые обладают запасом энергии, необходимым для осуществления той или иной реакции, то есть, избыточной энергией по сравнению со средней величиной энергии молекул. Такие молекулы получили название «активных» молекул. Переход неактивной молекулы в активную называется активацией. А избыточная энергия активной молекулы, благодаря которой становится возможной химическая реакция, носит название энергии активации (Ea). Единица измерения Ea Дж/моль или кДж/моль. Энергия активации бывает меньше энергии разрыва связей в молекуле, так как для того чтобы молекула прореагировала, вовсе не требуется полного разрыва связей, их достаточно лишь ослабить.
Величина энергии активации зависит от того, в какую реакцию эта молекула вступает. Иными словами, каждая химическая реакция характеризуется свойственной ей величиной энергии активации. Если реакция идет между атомами или свободными радикалами, то обычно она не превышает 40 кДж/моль, а если между молекулами, то – 150-250 кДж/моль, в полимерах она может достигать 400 кДж/моль. Если Ea выше наибольшей величины, то такая реакция невозможна.
Энергия активации молекул может быть снижена под воздействием внешних факторов: повышение температуры, лучистой энергии, катализаторов и др. Энергия активации проявляется в активных молекулах по-разному: активные молекулы могут обладать большей скоростью движения, повышенной энергией колебания атомов в молекуле и др.
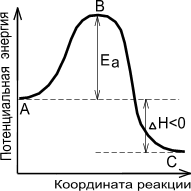
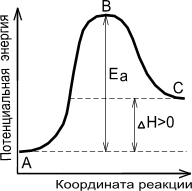
На рис. 7 показано, что скорость реакции пропорциональна числу активных молекул и зависит от величины энергии активации. На этом рисунке по оси ординат отложена энергия рассматриваемой системы молекул, а на оси абсцисс – ход реакции. Если реакция перехода из состояния А в состояние С идет с выделением тепла (экзотермическая реакция), то общий запас энергии продуктов реакции будет меньше, чем исходных веществ. Причем разность энергетических уровней А и С будет равна тепловому эффекту реакции (DН). Энергетический уровень В характеризует то наименьшее количество энергии, которым должны обладать молекулы, чтобы при столкновении друг с другом они прореагировали. Разность между уровнем В и уровнем А характеризует энергию активации прямой реакции, разность между уровнями В и С – энергию активации обратной реакции. Для эндотермической реакции применимы те же рассуждения, но величина энергии активации будет выше, чем у экзотермической реакции. Таким образом, при переходе из состояния А в состояние С система должна преодолеть энергетический барьер, то есть, должна обладать определенным избытком энергии, чтобы вступить в химическое взаимодействие.
Следовательно, скорость химической реакции зависит от величины энергии активации: чем она больше, тем медленнее будет протекать данная реакция. С другой стороны, чем меньше энергетический барьер реакции, тем большее число молекул будет обладать необходимой избыточной энергией, и тем быстрее будет протекать эта реакция. Итак, скорость химической реакции в конечном итоге зависит от соотношения между числом активных и неактивных молекул
В теории активных соударений Аррениус показал, что количество активных молекул может быть вычислено по закону Максвелла-Больцмана:
Nакт = Nобщe–Eа/RT, (5.27)
где Nакт – число активных молекул;
Nобщ – общее число молекул;
e – основание натуральных логарифмов;
Eа – энергия активации, моль/Дж;
R – молярная газовая постоянная, Дж/(мольК);
T – абсолютная термодинамическая температура, К.
Уравнению (5.27) можно придать вид:
k = kоe–Eа/RT (5.28)
или после логарифмирования:
lnk = lnkо – 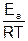 , (5.29)
, (5.29)
где k – константа скорости при обычных условиях;
kо – константа скорости при условии, что все столкновения приводят к реакции.
| 
|
| Экзотермическая реакция | Эндотермическая реакция |
Рис. 7. Энергетическая диаграмма химической реакции: уровень
А – исходные реагенты, уровень В – активированный комплекс (переходное состояние), уровень С – продукты реакции.
Сравнение уравнений (5.7) и (5.29) позволяет выяснить физический смысл констант в уравнении Аррениуса. A = Eа/RT характеризует энергию активации процессов (Eа), а B = lnkо, т. е. равно логарифму числа столкновений за 1 с в единице объема.
Если известны константы скорости k1 и k2 при двух температурах T1 и T2, то можно найти значение Eа из уравнения (5.29):
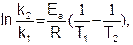 (5.30)
(5.30)
или, заменяя натуральный логарифм десятичным, можно записать:
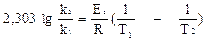 . (5.30)
. (5.30)
Таким образом, рост скорости реакции с повышением температуры объясняется тем, что с увеличением температуры увеличивается не только средняя кинетическая энергия молекул, но и одновременно, как следует из уравнения (5.7), резко возрастает доля молекул, обладающих энергией выше определенного уровня, то есть, доля активных молекул, способных к реакции.
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 1709; Нарушение авторских прав?; Мы поможем в написании вашей работы!