
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ковалентная связь
|
|
|
|
Химические связи
Поляризация ионов
Влияние друг на друга близко размещенных, противоположно заряженных ионов вызывает их взаимную поляризацию. При сближении ионов происходит смещение электронов по отношению к ядру и возникает наведенный (индукционный) дипольный момент (μинд). С одной стороны μинд равно произведению заряда электрона на расстояние между центрами тяжести положительного и отрицательного заряда. С другой – произведению напряженности на поляризуемость.
Для простоты будем считать, что поляризация иона обусловлена только деформацией внешних электронных оболочек. При равных зарядах и близких радиусах минимальная поляризация наблюдается у ионов с конфигурацией благородных газов, а максимальная поляризация – у ионов с 18 внешними электронами. Ионы оказывают интенсивное поляризующее воздействие.
μинд = е · l
μинд = E · α
где е – заряд электрона
E – напряженность
α ~ r 3 – поляризуемость
Задание.
Пользуясь законом Кулона, оценить напряженность электрического поля на расстоянии
r = 10Å = 10-7см;
|е| = 4,8·104эл.ед.
Ковалентная связь возникает между двумя атомами, если неспаренные электроны, находящиеся на внешних электронных уровнях двух атомов, обладают противоположном направленными спинами неспаренных электронов. При этом два электрона образуют общую (поделенную) пару электронов.
Ковалентная связь не затрагивает электроны во внутренних слоях атома.
Анализ квантово-механического расчета взаимодействия двух атомов водорода показывает, что антипараллельность спинов двух электронов приводит к перекрыванию электронных облаков обоих атомов. В результате возникает электронное облако с наибольшей плотностью отрицательного заряда между атомами. При этом изменяется потенциальная энергия системы, т.е. возникает химическая связь.
При антипараллельности спинов их волновые функции складываются. В этом случае электронная плотность (определяющаяся ψ2) больше суммы электронной плотности двух электронных облаков изолированных атомов.
При антисимметричной волновой функции, которая характеризует электроны с параллельными спинами, плотность электронного облака падает до нуля, т.е. электроны выталкиваются из пространства между ядрами двух атомов, и химическая связь не образуется.
Метод молекулярных орбиталей
(квантово-механическое объяснение ковалентной связи).
Этот метод основан на том, что в поле ядер атомов, составляющих молекулу, имеется разрешенное состояние электронов, т.е. молекулярные орбитали, которые заполняются обобщенными электронами двух атомов.
Пример.
 σ*св.
σ*св.
 ↑ ↓ H↑ ↓Н
↑ ↓ H↑ ↓Н
H · · H 1s 1s







 ↑ ↑ Атомные орбитали
↑ ↑ Атомные орбитали
 H · · H σсв ↑↓
H · · H σсв ↑↓
 Молекулярные орбитали
Молекулярные орбитали
(образование ковалентной связи)
Пример.
Не
1s2
σ*св В следствие этого Не – инертный газ и не существует Не2.
 Hе↑ ↓Не
Hе↑ ↓Не
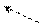
 1s ↓↑ 1s
1s ↓↑ 1s
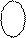




 ↑↓ ↑↓
↑↓ ↑↓
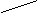
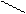

 σсв ↑↓
σсв ↑↓
Молекулярные орбитали
1) Каждый электрон в молекуле находится на определенной молекулярной орбитале, описанной соответствующей волновой функцией.
2) Каждой молекулярной орбитале отвечает определенная энергия.
3) На одной молекулярной орбитале могут находиться только два электрона с противоположно направленными спинами.
4) Волновая функция ψ, характеризующая движение всех рассматриваемых электронов в молекуле, рассматривается как произведение волновых функций отдельных электронов.
ψ = ψ1· ψ2·…· ψn
5) Межмолекулярные одноэлектронные волновые функции берутся как линейные комбинации волновых функций электронов в атомах, из которых образована молекула.
ψмo = C1ψАО+ C2ψАО1 +…+ CnψАОn
ψмo – волновая функция электрона на молекулярной орбите.
ψАО – волновая функция электрона на атомной орбитале.
6) σ-орбиталь, характеризующаяся меньшим запасом энергии, чем атомная орбиталь изолируемого атома, называется связующей.
В этом случае, при сложении атомных волновых функций, величины ψ в пространстве между ядрами возрастают. Появляется зона высокой электронной плотности, которая притягивает электроны, и образуется химическую связь.
7) σ*разр – это орбиталь, которая является энергетически менее выгодным состоянием, чем состояние отдельных атомных орбиталей.
В этом случае происходит вычитание отдельных электронных плотностей атомных орбиталей, вследствие чего электронная плотность между ядрами снижается, что приводит к отталкиванию ядер.
8) Молекулярные орбитали могут быть σs, πx, πy, πz.



 ↑ ↓ А.О. М.О.
↑ ↓ А.О. М.О.
 А.О. • • •+ •
А.О. • • •+ •

 σs
σs

 + –
+ –



 • • + – – +
• • + – – +
σp*











 Pz Pz
Pz Pz
σz








 – + + – – + –
– + + – – + –





 – + – + – + – + σ*
– + – + – + – + σ*
Py
 + + +
+ + +
 – – –
– – –
При комбинации двух s атомных орбиталей образуется две молекулярные орбитали: связывающая и разрыхляющая.
Следовательно, из 6 р атомных орбиталей (по три каждого атома: 2px2py2pz) образуется 6 молекулярных орбиталей (3 связывающих и 3 разрыхляющих).
Ψ = С1Ψ1 + С2Ψ2
Если Сi = 0 – несвязывающая орбиталь;
Сi > 0 – разрыхляющая орбиталь;
Ci < 0 – связывающая орбиталь.
Метод молекулярных орбиталей позволяет оценить химическую связь не только электронных пар но и отдельных электронов. Согласно этому методу, нахождение электронов на разрыхляющих орбиталях не только не создает химическую связь, но и приводит к отталкиванию атомов.
С помощью метода молекулярных орбиталей можно описать молекулярных орбитали только для простых атомов:
σ1s < σ*1s < σ2s < σ*2s < σ2pz < π2px < π2py < π*2px < π2py < σ*2pz
Данный метод позволяет предсказать:
· Возможность существования молекулы.
Химическая связь возникает, если количество электронов на связующих орбиталях (Ne) больше, чем на разрыхляющих.
свNe > разр Nе
Существование молекулы гелия не возможно, так как σ1s = 2 и σ*1s = 2. Следовательно гелий существует в виде атомов.
· Кратность химической связи.
|
· Магнитные свойства молекулы.
Н-Н является диамагнетиком, т.к. все электроны в молекуле спаренные.
Пример.
О2
1s2 2s2 2p4
| ↑↓ | ↑ | ↑ |
Заполнение молекулярных орбиталей выполняется по принципу Паули.
σp*z
 |







 ↓ ↑
↓ ↑






 ↑↓ ↓ ↓ ↑ ↑ ↑↓
↑↓ ↓ ↓ ↑ ↑ ↑↓




 z y x π2px π2py x y z
z y x π2px π2py x y z





 ↑↓ ↑↓
↑↓ ↑↓




 ↑↓
↑↓
 σpz
σpz
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 430; Нарушение авторских прав?; Мы поможем в написании вашей работы!