
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Полярные и неполярные молекулы
|
|
|
|
Z
Многоэлектронные атомы
Движение каждого электрона в атоме зависит не только от влияния ядра, но и от влияния других электронов.
Эффект экранирования состоит в уменьшении воздействия на электрон положительного заряда ядра в связи с наличием между рассматриваемым электроном и ядром других электронов. Этот эффект приводит к тому, что энергия электронов, обладающих равными n, но разными l различна. Следовательно, энергия электронов в многоэлектронных атомах определяется как n, и так и l. Чем больше электронов, тем более заметна зависимость энергии электронов от l. Заполнение электронами в многоэлектронных атомах осуществляется по принципу Паули.
Принцип Паули:
В любом атоме или молекуле не может быть двух электронов с одинаковым набором значений четырех квантовых чисел.
С ростом заряда на единицу, в поле заряда попадает электрон в наименьшее электронное состояние, т.е. состояние с наименьшим значением n + l.
Следствия:
1. Максимальное значение числа электронов в уровне равно 2n2;
2. Максимальное значение числа электронов на подуровне равно 2(2 l +1).
Последовательность заполнения электронами уровней в многоэлектронном атоме идет по следующему принципу:

1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<5d1[*]<4f 14<5dот2до10<6p<7s<6d1<5f 14<6d2
Пример.
Bi 83
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f 14 5d10 6p3
S–элементы – элементы, атомы которых заполняются одним или двумя электронами s подуровня внешнего уровня, при наличии в предпоследнем уровне двух или восьми электронов.
У p–элементы – электронами заполняется p подуровень внешнего уровня.
У f–элементы – электронами заполняется f подуровень n–2 уровня.
У d–элементы – электронами заполняется d подуровень предпоследнего n–1 уровня. А на внешнем уровне находятся один или два s-электрона.
Разница между ожидаемым числом электронов в многоэлектронных атомах и реальным числом электронов (проскоки электронов) объясняется тем, что уравнение Шредингера строго может быть решено только для изолированного атома водорода, где энергия электрона определяется только n.
Для заполнения квантовых ячеек используют правило Гунда.
Правило Гунда:
В данном подуровне заполнение электронных оболочек происходит таким образом, чтобы суммарный спин был максимальным.
Задание.
Написать строение Sm 62
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 5d1 4f 5
Задание.
Найти элемент, у которого на внешнем уровне 5d4.
Ответ: W
Валентность (ковалентность)
Валентность – определяется числом ковалентных связей, которые образует атом. Образовывать ковалентные связи могут только неспаренные электроны, т.е. они и определяют валентность.
Переход электрона на более высокий энергетический уровень осуществляется тогда, когда затрата энергии на возбуждение компенсируется энергией, выделяющейся при образовании химической связи. В случае инертных газов для возбуждения атомов требуется очень большая энергия затраты. Это и объясняет их инертность.
Валентность атомов выражает одно из свойств ковалентной связи – насыщаемость.
| Элемент | Электронная формула | 1s | 2s | 2p | Число неспаренных электронов | Число электронов в возбужденном состоянии | ||
| x | y | z | ||||||
| Li | 1s2 2s1 | ↑↓ | ↑ | |||||
| Be | 1s2 2s2 | ↑↓ | 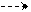 ↑↓ ↑↓
| 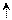
| ||||
| Cl | 1s2 2s2 2p1 | ↑↓ |  ↑↓ ↑↓
| ↑ | 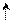
| |||
| C | 1s2 2s2 2p2 | ↑↓ |  ↑↓ ↑↓
| ↑ | ↑ | 
| ||
| N | 1s2 2s2 2p3 | ↑↓ | ↑↓ | ↑ | ↑ | ↑ | - | |
| O | 1s2 2s2 2p4 | ↑↓ | ↑↓ | ↑↓ | ↑ | ↑ | - | |
| F | 1s2 2s2 2p5 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑ | - | |
| Ne | 1s2 2s2 2p6 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | - |
Свойства атомов, меняющихся периодически
Для элементов в свободном виде (Ni, Fe, Au) характерны:
1. ковкость;
2. твердость;
3. плотность;
4. коэффициенты расширения и присоединении;
5. стандартные и окислительно-восстановительные электродные потенциалы;
6. Высокие температуры кипения и плавления;
7.? ∆H(плавления), ∆H(испарения), ∆H(сублимации);
8. тепло- и электропроводность.
Рассмотрим как в таблице Менделеева происходит изменение атомных и ионных радиусов электронов.
1) Атомные и ионные радиусы;
Рассмотрим как в таблице Менделеева происходит изменение атомных и ионных радиусов электронов.
Атомный радиус – расстояние, которое разделяет центры двух соседних атомов одного элемента. Радиус атома точно не определяется, т.к. электроны не строго локализованы, и электронное распределение может меняться из-за влияние соседних атомов.

 Радиус атома, соответствующий электронам 1 периода, уменьшается слева направо,
Радиус атома, соответствующий электронам 1 периода, уменьшается слева направо,
т.к. с ростом заряда ядра, растет сила притяжения.
2) Потенциал ионизации;
Энергия ионизации (I) – энергия, которую необходимо затратить для отрыва электрона от атома, находящегося в нормальном состоянии.
Na→Na++1e; [эВ]
Энергия ионизации зависит от удаленности электрона от ядра, заряда ядра, эффекта экранирования, проникновения электронов к ядру, взаимного отталкивания электронов, принадлежащих одному и тому же слою.
Согласно квантовой механики электрон может находиться а любой точке атома, то есть даже внешние электроны некоторое время могут находиться в области, близкой к ядру.
S-электроны являются самыми проникающими. Эффект проникновения увеличивает прочность связи.
увеличение энергии ионизации
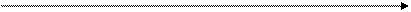
 Li Be B C N O F Ne
Li Be B C N O F Ne
5,39 9,32 9,30 11,26 14,53 13,61 14,72 21,56
Cs = 3,89
Рост по периодам объясняется увеличением заряда ядра при одном и том же количестве электронных слоев.
3) Сродство к электрону;
Сродство к электрону определяется энергией, которая выделяется при захвате атомом электрона с образованием аниона.
Пример.
C l 0 + e = C l –
Для многих атомов энергия притяжения дополнительного электрона к ядру превосходит энергию отталкивания электрона от электронных оболочек. Квантово-механический расчет показывает, что при присоединении двух и более электронов, энергия отталкивания больше энергии притяжения, поэтому одноатомные многозарядные ионы в свободном состоянии существовать не могут.
F – 3,62 эВ
C l – 3,71 эВ Максимальное сродство к электрону у галогенов.
Br – 3,49 эВ
I – 3,19 эВ
4) Электроотрицательность (Э.О.);
Электроотрицательность – арифметическая полусумма энергии ионизации и сродство к электрону.
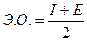 где I – энергия ионизации;
где I – энергия ионизации;
Е – сродство к электрону.

 Li Be B C N O F
Li Be B C N O F
1,0 1,5 2 2,5 3 3,5 4
Na
0,9
K Электроотрицательность характеризует стремление
0,8 данного атома к присоединению электронов
при образовании химических связей.
Cs
0,7
5) Степень окисления;
6) Оптические и магнитные свойства.
Когда зона максимальной электронной плотности суммарного электронного облака симметрично расположена относительно ядер обоих атомов. Такая связь называет неполярной (гомополярной).
Молекула, состоящая из атомов разных элементов, называется полярной (гетерополярной). Смещение электронной плотности происходит в сторону более электроотрицательного атома. Такая молекула представляет собой диполь.
Дипольный момент (μ) – мера полярности. Он равен произведению заряда электрона на расстояние между центрами тяжести положительного и отрицательного заряда.
[μ]=[Дебай]
LiF BeF2 BF3 CF4 NF3 OF2 F2
доля ковалентная связь

 доля ионная связь
доля ионная связь
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 981; Нарушение авторских прав?; Мы поможем в написании вашей работы!