
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Строение вещества
|
|
|
|
Двойственная структура микрочастиц
Современная квантово-механическая теория строения атомов и молекул учитывает как корпускулярные, так и волновые свойства электронов и других микрообъектов. Дифракция составляет волновые свойства. Фотоэлектронная эмиссия – корпускулярные.
Принцип непрерывности Гейзенберга
Невозможно одновременно с достаточной точностью определить положение электрона и его скорость.
∆Х∆рх ≥ h
Квантовая механика заменяет классическое понятие точного места нахождения частицы понятием статистической вероятности нахождения электрона в данной точке пространства или в элементе объема атома dV.
Уравнение Шредингера
Движение микрочастиц описывается уравнением Шредингера, которое играет роль подобную роли законов Ньютона в классической механике. Он полностью описывает положение электрона в атоме.
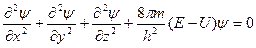
где ψ – волновая функция (полностью описывает положение электрона в атоме (орбиталь));
Е – полная энергия;
U – потенциальная энергия.
Физический смыл ψ
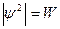
где W – плотность вероятности нахождения электрона в точке с координатами x,y,z в момент времени τ.
Вероятностное описание движения электрона приводит к представлению о том, что электрон как бы «размазан» вокруг ядра и образует той или иной формы электронное облако, плотность которого в разных точках определяется вероятностью пребывания электрона в них.
 Модель Бора
Модель Бора
Бор считал, что электроны движутся по стационарным орбитам, номера которых равны числу полуволн (волновые свойства электрона). Находятся эти атомные орбитали на расстоянии радиуса Бора, так как в этом случае плотность вероятности пребывания электрона максимальна.
|

Свойства уравнения Шредингера таковы, что оно может быть решено только для некоторого дискретного значения полной энергии. Эти решения пропорциональны ряду целых чисел.
Квантовые числа:
1) Главное квантовое число (n)
Определяет энергетический уровень.
n=1,2,3,…,n
2) Орбитальное квантовое число ( l )
Определяет энергетический подуровень и форму электронного облака.
l =0,1,…,n+1
3) Магнитное квантовое число (m)
Определяет ориентацию электронного уровня в магнитном поле.
m = – l,…,0,… l
4) Спиновое квантовое число (s)
Определяет направление вращения электронов вокруг собственной оси.
s= ± ½
Форма электронного облака определяется вероятностью нахождения электрона в объеме dV.
Для s-электронов
ψ2dV зависит только от радиуса, образуя сферическую симметрию.
 ψ2dV Поэтому облако одного 1s электрона имеет форму, изображаемую
ψ2dV Поэтому облако одного 1s электрона имеет форму, изображаемую


 окружностью.
окружностью.
r◦ r
dS
Для p-электронов

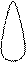
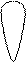 Y Электронное облако изображается тремя линейно независимыми
Y Электронное облако изображается тремя линейно независимыми
эквивалентными «восьмерками».




 X
X
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 286; Нарушение авторских прав?; Мы поможем в написании вашей работы!