
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Строение атома углерода и других биогенных элементов
|
|
|
|
Квантово-механическое представление в органической химии
В органической химии
Все многообразие органических соединений может быть объяснено только особенностями электронного строения атома углерода, его способностью образовывать прочные электронные связи между собой и другими химическими элементами.
Углерод – самый маленький из четырехвалентных атомов. Поэтому облака углеродов перекрывают друг друга в достаточной степени для образования связи между собой. Это является причиной появления мощной области электронной связи.
6С12
 1p+=6 Ядро 1s2 2s2 2p2
1p+=6 Ядро 1s2 2s2 2p2








 1n0=6
1n0=6
e–=6
В обычном (стационарном) состоянии в атоме углерода два неспаренных электрона. Следовательно, углерод в этом состоянии двухвалентен.
С*: 1s2 2s1 2p3










При сообщении атому дополнительной энергии, он переходит в возбужденное состояние (С*). Эта энергия затрачивается на разъединение 2s2 электронов и на переход одного из них на 2p орбиталь.




 Y E
Y E
 2py
2py
 2pz
2pz
Lсв.


 X
X
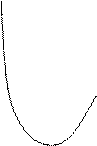
∆E r
E – энергия
 2px Emin r – радиус
2px Emin r – радиус
Z ∆E – энергия связи
Энергия связи – энергия, которая выделяется при образовании связи. Система с меньшей энергией более стабильна. Связанная система обладает меньшей энергией.
 |  |
+ е– е– +
 | |||
 |
+ е– е– +


 е–
е–

 + +
+ +
е–

 -оптимальное расстояние, соответствующее минимальной энергии.
-оптимальное расстояние, соответствующее минимальной энергии.
+ + При дальнейшем сближении электроны будут отталкиваться.
Характеристики связей: энергия связи, длина, полярность, угол между связями.
Если бы атом углерода образовывал четыре ковалентных связи (СН4) с помощью исходных атомных орбиталей, то все связи были бы не равноценны по своим характеристикам. Но опыт показывает, что все связи в атоме углерода равноценны. Этот феномен может быть объяснен с точки зрения гибридизации. В результате этого процесса из исходных орбиталей, различающихся по форме и положению в пространстве, образовываются гибридные атомные орбитали.
Валентные состояния четырех валентного углерода:
I валентное состояние (Sp3-гибридизация)
(S+px+pz+py)
Sp3+ Sp3+ Sp3+ Sp3
 …2(Sp3)4
…2(Sp3)4






 СН4
СН4
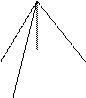 |



 109°28’
109°28’





Области перекрывания равны.
 |
Из-за направления связей молекула выглядит так:
 |
Sp3 могут перекрываться с орбиталями других форм, образуя одну область перекрывания, расположенную по оси, соединяющей ядра атомов (осевое перекрывание). Как следствие – одинарная связь (σ).
II валентное состояние (Sp2-гибридизация)
(S+px+pz)+py
 Sp2+ Sp2+ Sp2+p
Sp2+ Sp2+ Sp2+p
 …2(Sp2)32р1
…2(Sp2)32р1


 σ+π π связь – только не
σ+π π связь – только не



 гибридизованные орбитали.
гибридизованные орбитали.
 | |||
 | |||




120°
Это плоская молекула.
Две области перекрывания расположены по обе стороны от оси
(параллельно друг другу).
π связь образуется только между уже связанными атомами.
Она накладывается на имеющуюся связь и образует кратную связь.
Пример.
С2Н4
Н2С=СН2 





 |








 |
3 валентное состояние (Sp-гибридизация)
(S+px)+pz+py
Sp+ Sp+ p+p
…2(Sp)2(р)2
 Sp менее вытянута, чем Sp3.
Sp менее вытянута, чем Sp3.


 Spy Spz
Spy Spz
Sp S + π + π
S + π + π







 Пространственная плоская линейная структура
Пространственная плоская линейная структура
Sp 180° Пространственная конфигурация молекул обусловлена направлением в
пространстве атомных орбиталей, образующих связь.
Пример.
С2Н2
Н – С ≡ С – Н 



 |










 |
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 636; Нарушение авторских прав?; Мы поможем в написании вашей работы!