
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
II. Квантово-механическое представление
|
|
|
|
I. Введение
Органическая химия – химия, углеводородов и их соединений.
В современном понимании, Фридрих Веллер разделил органическую и неорганическую химию. Он первый получил органическое вещество (мочевину) из неорганических веществ.
Опыт Веллера:
NH3+HC l →NH4C l
NH3+HOCN→NH4OCN (цианид аммония)
NH4OCN↔(NH2)2CO (мочевина)
В 40-е годов XIX в. была сокрушена теория Витализма*. Появился органический синтез. На сегодняшний день количество органических соединений превышает 20 млн.
С увеличение количества органических веществ возникла необходимость в их классификации. Проводя органический синтез, ученые обнаруживали все больше закономерностей при переходе одного вещества в другое. Как следствие этого, понадобились способы классификации органических веществ. Начали возникать различные теории. Например, теория группировки и р адикальная теория. По последней предполагали, что радикалы не изменяются а переходят из одного соединения в другое.
Пример.
C2H5OH;
C2H5Cl; (гидрохлорид этерина)
C2H5 – O – C2H5;
Здесь C2H5 – радикал. А также спирт и эфир являлись гидроксид этерином.
Пример.




 O O
O O
 C6H5 – C → C6H5 – C
C6H5 – C → C6H5 – C
H OH
Но эта теория не могла объяснить тот факт, что возможна замена радикала на другие атомы, а природа вещества остается той же.
Пример.

 O
O
 CH3 – C (уксусная кислота)
CH3 – C (уксусная кислота)
OH

 O
O
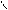 C l – CH2 – C (хлоруксусная кислота)
C l – CH2 – C (хлоруксусная кислота)
OH
В дальнейшем теорию радикалов сменила теория Типов. По этой теории одно и тоже вещество могло быть отнесено к одному из пяти различных типов:
· Водород;
· Вода;
· Метан;
· Хлористый водород;
· Аммиак.
Пример.
CH4→ СН3 – H → к водороду
CH3OH → CH3 – O – H → к воде
Так как одно и то же вещество можно было отнести сразу к нескольким типам, то это приводило к разночтениям и позволяло описывать только простые вещества. Решил эту проблему систематизаций органических веществ Бутлеров.
Теория Бутлерова (1868)
Теория Бутлерова содержит в себе шесть положений:
1положение. Атомы в молекулах соединены в определенной последовательности так, что свободных валентностей не остается.
2положение. Последовательность, по которой соединены атомы, отражает химическое строение молекулы.
3положение. Свойства веществ зависят не только от числа и природы атомов, входящих в состав молекулы вещества, но и от химической структуры.
4положение. Вещества, имеющие одинаковый качественный и количественный состав, т.е. одинаковую молекулярную формулу, но различное химическое строение, поэтому обладающие различными свойствами, называются изомерами.
5положение. Атомы в молекулах оказывают друг на друга определенное влияние. При чем влияют не только непосредственно связанные (соседние) атомы, но и дистанцированные атомы.
6положение. Химическое строение вещества можно определить по результатам химических реакций. И наоборот, по строению вещества можно прогнозировать реакции.
Следствие. Каждое вещество должно иметь одну химическую формулу, отражающую его строение.
Пример.
C2H6O
СH3 – CH2 → Oδ-← Hδ+ – этиловый спирт.
Это вещество жидкость, т.к. есть положительно поляризованный атом водорода.
C2H5 – O δ-← Hδ+
•
•
•
O ← C2H5
|
H
CH3 – O – CH3 – диэтиловый эфир. А это уже газ.
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 405; Нарушение авторских прав?; Мы поможем в написании вашей работы!