
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Рост кристаллов
|
|
|
|
Образование центров кристаллизации.
КИНЕТИКА
Процесс кристаллизации из растворов включает две стадии:
1. образование центров кристаллизации,
2. рост кристаллов.
Обозначим:
N – число образовавшихся центров,
 - скорость образования центров кристаллизации.
- скорость образования центров кристаллизации.
Скорость образования центров кристаллизации зависит от пересыщения

Эту зависимость часто представляют в виде  .
.
Существуют теории:
1. гомогенного образования центров (Гиббс, Тамман), согласно которой центрами кристаллизации становятся сиботаксические группы (блоки) вещества в растворе;
2. гетерогенного образования центров (современные авторы), согласно которой центрами кристаллизации могут быть примеси (пылинки) и инородная поверхность.
Для стадии роста кристаллов применимо основное уравнение массопередачи
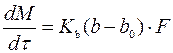 (177)
(177)
Коэффициент массопередачи 
Коэффициенты массоотдачи:
 - учитывает стадию диффузии вещества к поверхности кристалла.
- учитывает стадию диффузии вещества к поверхности кристалла.
Для растворов этот коэффициент определяется из критериального уравнения:
 (178)
(178)
В уравнении (178) 
L – характерный линейный размер кристалла.
Часто полагают 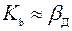 .
.
 - учитывает стадию поверхностной реакции (миграция молекул или блоков вещества по поверхности кристалла до присоединения), надёжных формул для определения не существует.
- учитывает стадию поверхностной реакции (миграция молекул или блоков вещества по поверхности кристалла до присоединения), надёжных формул для определения не существует.
При росте кристалла его поверхность переменна F=var.
Поэтому полагают  .
.
От уравнения (177) переходят к уравнению (179)
 (179)
(179)
Когда  , правило Мак-Кэба.
, правило Мак-Кэба.
Когда 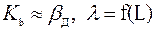 .
.
Следовательно зависимость  отражает преимущество той или иной стадии роста кристаллов.
отражает преимущество той или иной стадии роста кристаллов.
Кинетика применяется для определения фракционного состава кристаллов в процессе кристаллизации. Это предсказание приближенно, т.к. трудно учитывать другие факторы (природа кристаллизующейся соли, температура, примеси и др.).
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 482; Нарушение авторских прав?; Мы поможем в написании вашей работы!