
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция № 3. Классификация реакции по знаку теплового эффекта
|
|
|
|
Классификация реакции по знаку теплового эффекта
DrU = Qv > 0
DrН = Qр > 0 реакция эндотермическая
DrU = Qv < 0
DrН = Qр < 0 реакция экзотермическая
4.3.4. Связь Qр и Qv в химических реакциях
DrН = DrU + p DrV
В химических реакциях объем изменяется, если изменяется число молей газообразных веществ
pDrV = Drnгаз RT.
При расчете на один пробег изменение числа молей газообразных ве-ществ равно алгебраической сумме стехиометрических коэффициентов этих веществ
Drnгаз = 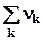 газ =(
газ =(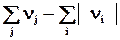 )газ = D ên k êгаз
)газ = D ên k êгаз
DrН = DrU + Dr ên k êгаз ∙ RT (2.17)
Пример: 1/2N2 + 3/2 H2 = NH3 DrH = -46, 19 кДж/моль = Qp
nk -1/2 -3/2 1 Dn = -1
QV = Qp + RT = -46190 + 8,314 298 = -43710 Дж/моль = - 43, 71 кДж.моль
4.3.5. Применение закона Гесса. Закон Гесса позволяет комбинировать стехиометрические уравнения, вкладывая в них термохимический смысл. Любые линейные комбинации с одинаковыми общими уравнениями имеют один и тот же тепловой эффект. Это позволяет легко определять теплоты реакций, которые трудно экспериментально провести до конца в соответствие с требованиями
H2 + O2 = H2O2 DrH-?
+1 ç H2 + 1/2 O2 = H2O DrH1 = -285.8 кДж/моль
–1 ç H2O2 = H2O + 1/2O 2 DrH2 = -98,7 кДж/моль
H2 + O2 = H2O2
Подбираем коэффициенты линейной комбинации уравнений реакций, теп-лоты которых известны, чтобы в сумме получалось заданное уравнение. С такими же коэффициенты данные теплоты войдут в искомую теплоту.
DrH = DrH1 - DrH2 = -285,8 – (-98,7) = -187,1 Кж/моль
Энергетическая диаграмма – графическое изображениеуровней реаги-рующих веществ – позволяет наглядно представить эти процессы и нахо-
________________ H2 + O2 дить любые неизвестные теплоты по

 имеющимся данным путем составле-
имеющимся данным путем составле-
-187.1 ния циклов, суммарная теплота кото-
рых равна 0.

 -285.8 H2 O2
-285.8 H2 O2
-98.7
 H2O + 1/2 O2
H2O + 1/2 O2
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 341; Нарушение авторских прав?; Мы поможем в написании вашей работы!