
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расчет изменения энтропии в некоторых процессах
|
|
|
|
1. Фазовые переходы:
а) твердое тело – жидкость
б) Твердое тело – газ
в) Жидкость – газ
Согласно определению, 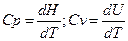 , энтальпия (внутренняя энергия) этих процессов будет определяться изменением теплоемкостей. С другой стороны, согласно 2 закону термодинамики, изменение энтропии в ходе фазового перехода можно рассчитать:
, энтальпия (внутренняя энергия) этих процессов будет определяться изменением теплоемкостей. С другой стороны, согласно 2 закону термодинамики, изменение энтропии в ходе фазового перехода можно рассчитать:
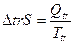
 Проводя процесс в изобарных условиях,
Проводя процесс в изобарных условиях, 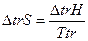
тепловой эффект в
фазовых переходах
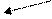 Проводя процесс в изохорных условиях,
Проводя процесс в изохорных условиях, 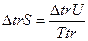
Большинство процессов протекает в неравновесных условиях. Однако, энтропия является функцией состояния, поэтому её изменение будет одинаково в обоих случаях и может быть рассчитана по приведенным формулам.
2. Нагревание в конденсированной системе.
W=0
а) Изобарное нагревание (p=const)
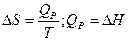
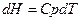
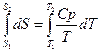
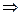
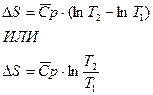
б) Изохорное нагревание (V=const)
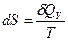
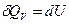
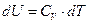
аналогично
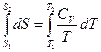
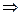
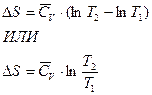
3. Нагревание газообразных систем (с учетом работы расширения)
а) Изобарное нагревание (p=const)
В данном случае необходимо воспользоваться объединенным уравнением I и II Закона Термодинамики без учета полезной работы:
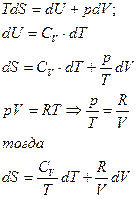
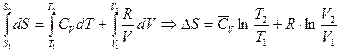
б) Изохорное нагревание (V=const)
воспользоваться объединенным уравнением I и II Закона Термодинамики, записанным через энтальпию!
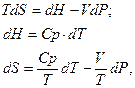

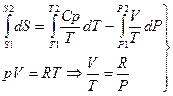
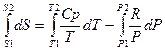
4. Смешение идеальных газов:
Каждый из двух смешивающихся газов имеет свои характеристики: n, Cp, V, T, P и т.д.
Из свойств энтропии следует, что она должна обладать свойствами аддитивности (складывания), поэтому общее изменение энтропии в системе будет равно сумме изменений отдельных её частей, с учетом их количеств!
Так как процесс смешения изобарный (P1=P2=Pобщ), в то же время суммарный объем системы будет складываться из двух частей: Vобщ=V1+V2
В это же время, итоговая температура смеси должна находиться между T1 и Т2.
Предположим, T1 > Т2. В этом случае первый газ будет остывать, и количество отданного тепла будет находиться, как 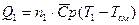 . Одновременно с этим, второй газ будет нагреваться и количество теплоты, которое примет газ будет равно
. Одновременно с этим, второй газ будет нагреваться и количество теплоты, которое примет газ будет равно 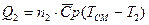 .
.
Так как первый газ нагревается от второго, 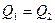 . Тогда
. Тогда
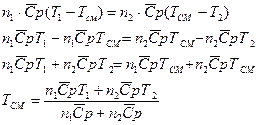
Таким образом, можно вычислить температуру газа после смешения. Так как в результате смешения происходит в основном расширение газов и изменение его температуры, необходимо воспользоваться формулой для расчета изменения энтропии в процессе изобарного расширения:
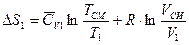
С учетом изменения энтропии второго газа:
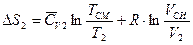
можно записать:
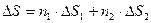
Лекция №4.
План лекции:
1. III Закон Термодинамики. Определение, математическая запись.
2. Расчет основных значений энтропии.
3. Применение III Закона Термодинамики к химическим реакциям.
4. Термодинамическое описание закрытых систем с постоянным составом.
термодинамические потенциалы.
5. Свойства термодинамических потенциалов.
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 583; Нарушение авторских прав?; Мы поможем в написании вашей работы!