
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вблизи абсолютного нуля все процессы протекают без изменения энтропии!
|
|
|
|
Вблизи абсолютного нуля энтропия абсолютно правильного бездефектного кристалла равна нулю!
III Закон Термодинамики
Данный закон состоит из двух постулатов:
1. Постулат Планка:
2. Тепловая теория Нернста:
Математическую формулировку данного закона можно представить в виде формулы:
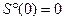
III Закон Термодинамики показывает условие, при котором энтропия равна нулю, то есть дает начало отчета энтропии и позволяет рассчитать её абсолютное значение.
Очевидно, что абсолютный «нуль» температур невозможен, однако постулатом Планка можно пользоваться без особых ограничений, так как он лишь фиксирует начало отчета!
Расчет абсолютных значений энтропии
В общем случае расчет сводится к суммированию изменений энтропии на определенных участках, которые проходит система для достижения определенной температуры.




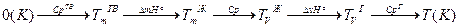
нагрев. плавл. нагрев. испарен. нагрев.
температура температура
плавления кипения
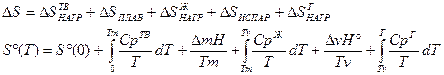
Данная формула позволяет рассчитать абсолютные значения энтропии 1 моль вещества, находящегося при температуре Т в газообразном состоянии.
Для многих веществ посчитаны энтропии при стандартных условиях, поэтому
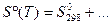
При расчете абсолютных энтропий твердых тел вблизи абсолютного нуля используется температурный ряд теплоемкостей в виде кубического полинома (многочлена) 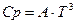
Данная зависимость хорошо работает до температуры T=80K, поэтому второе слагаемое чаще всего разбивают на два: 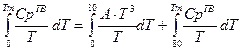
Применение III Закона Термодинамики к химическим реакциям
Так как для большого количества веществ абсолютные энтропии табулированы, то с помощью III Закона Термодинамики можно рассчитать изменение энтропии в результате химической реакции по абсолютным значениям энтропии:
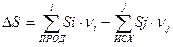
Если реакция протекает при температуре, отличной от стандартной, то изменение энтропии будет находиться, как
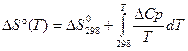
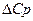 может быть заменено изменением средней теплоемкости. В этом случае после подстановки средней теплоемкости и интегрировании получаем:
может быть заменено изменением средней теплоемкости. В этом случае после подстановки средней теплоемкости и интегрировании получаем:
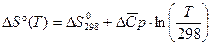
Так же 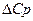 может быть заменено температурным рядом. Тогда:
может быть заменено температурным рядом. Тогда:
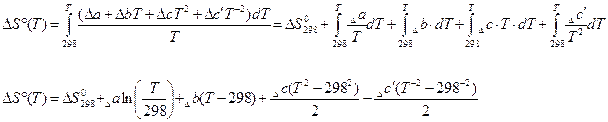
Термодинамическое описание закрытых систем с постоянным составом.
термодинамические потенциалы
Термодинамический потенциал – термодинамическая функция, показывающая направление процесса, то есть возможность самопроизвольного протекания химических реакций в выбранном направлении.
Первым термодинамическим потенциалом служила энтропия. К сожалению, этот критерий направленности работает только в изолированных системах и не применим к реальным системам.
Теплота, выделяющаяся или поглощающаяся в ходе химической реакции так же не может служить критерием направленности, поэтому основным критерием направленности процесса была принята работа.
а) Если работа совершается системой, W>0(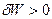 ), процесс считается самопроизвольным.
), процесс считается самопроизвольным.
б) Если работа совершается над системой, процесс считается не самопроизвольным W<0, (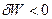 ),
), 
Однако, использовать работу в качестве критерия направленности не очень удобно, так как она является функцией процесса и будет зависеть от пути процесса.
Таким образом, термодинамический потенциал – функция, связанная с работой и являющаяся критерием направленности процесса, то есть функцией состояния!
Очевидными, критерием направленности является изменение внутренней энергии и энтальпии. Однако, данные критерии будут реализовываться только в специфических условиях.
Запишем объединенное уравнение I и II Закона Термодинамики
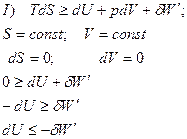
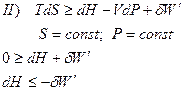
Вывод: Для того, чтобы изменение энтальпии или внутренней энергии служили критериями направленности процесса, необходимо постоянство энтропии, чего в реальных условиях добиться невозможно!
Для реальных процессов были выбраны другие критерии направленности.
I) Изохорно-изотермический процесс:
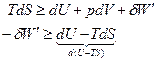
U-TS=A(F) – Свободная энергия Гельмгольца
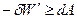
Таким образом, свободная энергия Гельмгольца является критерием направленности процесса в изохорно-изотермических условиях. Поэтому её называют ' Изохорно-изотермическим потенциалом '.
Таким образом, самопроизвольный процесс в изохорно-изотермических условиях будет считаться процесс с уменьшением энергии Гельмгольца.
Если над системой совершается насилие (работа), то 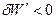
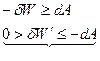
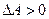
То процесс считается не самопроизвольным!
II) Изобарно-изотермический процесс:
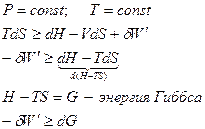
Самопроизвольным считается процесс в изобарно-изотермических условиях, идущий с уменьшением энергии Гиббса. 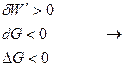
Для не самопроизвольного процесса 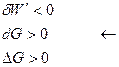
Для состояния равновесия 
Вывод: Таким образом, исходя из объединенного уравнения I и II Закона Термодинамики, можно сделать вывод, что в изохорно-изотермических условиях в качестве критерия самопроизвольности процесса выступает энергия Гельмгольца; в изобарно-изотермических условиях – энергия Гиббса.
Если изменение Энергии Гиббса в изобарно-изотермических условиях или энергии Гельмгольца в изохорно-изотермических условиях меньше нуля, процесс считается самопроизвольным.
Если изменение этих же самых величин больше нуля, это свидетельствует о невозможности самопроизвольности данного процесса.
Если изменение этих же самых величин равны нулю, это свидетельствует о нахождении системы в состоянии равновесия.
Введенные величины, G и A связаны с понятием энтропии, поэтому говорят, сто энтропия выражает основное свойство природы – односторонность протекания процессов!
Свойства термодинамических потенциалов
Все свойства термодинамических потенциалов основаны на свойствах полного дифференциала и первой производной. Дифференцирование любого термодинамического потенциала проводится по естественным переменным, то есть тем величинам, которые должны сохраняться постоянными для придания работе свойств функции состояния.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 1032; Нарушение авторских прав?; Мы поможем в написании вашей работы!