
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Свойства энергии Гельмгольца
|
|
|
|
Данный термодинамический потенциал в качестве естественных переменных использует объем (V) и температуру (Т), поэтому полный дифференциал будет равен сумме частных производных по температуре и объему.
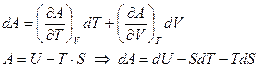
Для обратимого равновесного процесса принимается, что 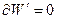 , то есть процесс протекает бесконечно медленно через бесконечно большое число состояний равновесия, поэтому объединенное уравнение I и II Закона Термодинамики в изохорно-изотермических условиях:
, то есть процесс протекает бесконечно медленно через бесконечно большое число состояний равновесия, поэтому объединенное уравнение I и II Закона Термодинамики в изохорно-изотермических условиях:
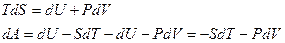
Из сравнения двух выражений для полного дифференциала следует, что
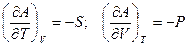
Таким образом, воспользовавшись свойством первой производной, можно сказать, что энергия Гельмгольца всегда будет уменьшаться с ростом энтропии для индивидуального вещества: 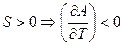 , следовательно, с ростом температуры энергия Гельмгольца уменьшается!
, следовательно, с ростом температуры энергия Гельмгольца уменьшается!
С другой стороны, с ростом объема, свободная энергия Гельмгольца так же будет уменьшаться для индивидуального вещества: 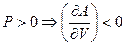
С другой стороны, записывая данное неравенство для химической реакции, следует использовать не абсолютные значения, а их изменения, то есть:
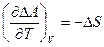
Изменение энтропии может быть как положительным, так и отрицательным и равным нулю! 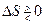 , поэтому изменение энергии Гельмгольца может, как и увеличиваться, так и уменьшаться с ростом температуры:
, поэтому изменение энергии Гельмгольца может, как и увеличиваться, так и уменьшаться с ростом температуры:
1) 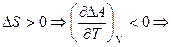 при увеличении температуры изменение энергии Гельмгольца будет уменьшаться, поэтому процесс становиться более самопроизвольным.
при увеличении температуры изменение энергии Гельмгольца будет уменьшаться, поэтому процесс становиться более самопроизвольным.
2) 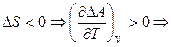 при увеличении температуры изменение энергии Гельмгольца будет увеличиваться, поэтому процесс становиться менее самопроизвольным.
при увеличении температуры изменение энергии Гельмгольца будет увеличиваться, поэтому процесс становиться менее самопроизвольным.
3) 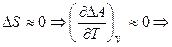 изменение энергии Гельмгольца не является функцией от температуры
изменение энергии Гельмгольца не является функцией от температуры 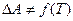 .
.
Аналогичным образом можно проанализировать влияние объема на смещение равновесия:
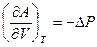
1) 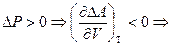 при увеличении объема изменение энергии Гельмгольца будет уменьшаться, поэтому процесс становиться более самопроизвольным.
при увеличении объема изменение энергии Гельмгольца будет уменьшаться, поэтому процесс становиться более самопроизвольным.
2) 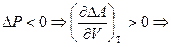 при увеличении объема изменение энергии Гельмгольца будет увеличиваться, поэтому процесс становиться менее самопроизвольным.
при увеличении объема изменение энергии Гельмгольца будет увеличиваться, поэтому процесс становиться менее самопроизвольным.
3) 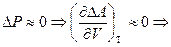 изменение энергии Гельмгольца не является функцией от объема
изменение энергии Гельмгольца не является функцией от объема 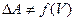 .
.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 1791; Нарушение авторских прав?; Мы поможем в написании вашей работы!