
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химический потенциал идеального газа
|
|
|
|
Рассмотрим однокомпонентную систему. В данном случае:
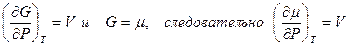
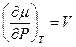 , следовательно
, следовательно 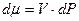
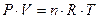
предположим, что система содержит один моль идеального газа, тогда: 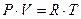
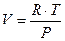
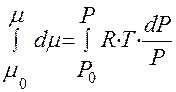 , где
, где
P0 – начало отчета давления, которое чаще всего приравнивают к стандартному давлению.
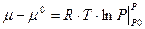
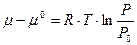
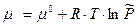 - выражение для химического потенциала 1 моль идеального газа.
- выражение для химического потенциала 1 моль идеального газа.
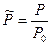
 Постараемся разобраться, что же это за функция, химический потенциал!
Постараемся разобраться, что же это за функция, химический потенциал!
Найдем взаимосвязь внутренней энергии (U), энтропии (S) и произведением PV.
Допустим, что равновесная газовая смесь содержит к индивидуальных веществ, и все они находятся в идеальном газовом состоянии. В смеси идеальных газов, как внутренняя энергия, так и энтропия системы являются аддитивными функциями состава. Рассмотрим сначала первое слагаемое в выражении энергии Гиббса. Согласно уравнению 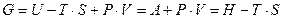 зависимость внутренней энергии для 1 моль i-го индивидуального вещества от температуры представим в виде
зависимость внутренней энергии для 1 моль i-го индивидуального вещества от температуры представим в виде 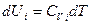
где 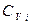 - молярная теплоемкость при постоянном объеме г-го газа. Примем в первом приближении, что Cv не зависит от температуры. Интегрируя при этом условии данное выражение, получаем:
- молярная теплоемкость при постоянном объеме г-го газа. Примем в первом приближении, что Cv не зависит от температуры. Интегрируя при этом условии данное выражение, получаем: 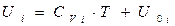 .
.
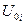 - внутренняя энергия 1 моль i-го газа при 0 К. Если газовая
- внутренняя энергия 1 моль i-го газа при 0 К. Если газовая
смесь содержит ni моль i-го газа, то: 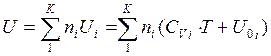 .
.
Второе слагаемое в выражении для энергии Гиббса, исходя из уравнения
Менделеева – Клапейрона, запишем в виде: 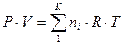 .
.
Рассмотрим третье слагаемое. Зависимость энтропии S одного моля i-го газа в газовой смеси от его относительного парциального давления 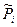 и температуры можно записать в виде:
и температуры можно записать в виде: 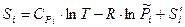 ,
,
где 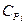 - молярная теплоемкость i-го компонента газовой смеси. В таком случае:
- молярная теплоемкость i-го компонента газовой смеси. В таком случае:
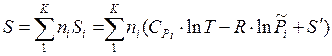
Подставив выражения для внутренней энергии (U), энтропии (S) и произведением PV в уравнение 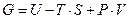 , получаем
, получаем
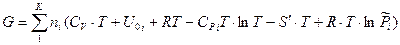
Первые пять слагаемых данного уравнения зависят только от природы индивидуального i-го вещества и температуры и не зависят от состава смеси и давления. Их сумма обозначается 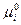 . Тогда:
. Тогда: 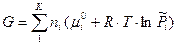
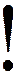 или
или 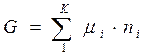 , где величина
, где величина 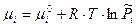 и называется химическим потенциалом, а величина
и называется химическим потенциалом, а величина 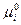 - стандартным химическим потенциалом, то есть химический потенциал 1 моль идеального газа при стандартном давлении и температуре.
- стандартным химическим потенциалом, то есть химический потенциал 1 моль идеального газа при стандартном давлении и температуре.
Химический потенциал – это энергия Гиббса, абсолютное значение которой неизвестно, поэтому неизвестно значение и стандартного химического потенциала. Если система содержит несколько компонентов, следует говорить о химическом потенциале отдельных компонентов: 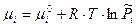
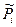 - относительное парциальное давление компонентов в системе; это такое давление газа, которое производило бы то количество газа в системе, если бы не было других газов.
- относительное парциальное давление компонентов в системе; это такое давление газа, которое производило бы то количество газа в системе, если бы не было других газов.
Парциальное давление газа в системе связано с общим давлением с помощью закона Дальтона: 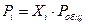
Лекция № 6
План лекции:
1. Уравнение изотермы системы. Связь энергии Гиббса с химическим потенциалом компонентов реакции.
2. Закон действующих масс. Стандартная константа равновесия.
3. Практические константы равновесия.
4. Химическое равновесие в гетерогенных системах.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 2776; Нарушение авторских прав?; Мы поможем в написании вашей работы!