
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Смещение химического равновесия при изменении концентрации реагентов
|
|
|
|
СО(г) + Н2О(г)ÛСО2 (г) + Н2 (г) + 43 кДж
Способы смещения равновесия.
Принцип Ле Шателье.
При постоянной температуре отношение произведения равновесных концентраций продуктов реакции, взятых в степенях, равных СТЕХИОМЕТРИЧЕСКИМ коэффи-циентам, к произведению равновесных концентраций исходных веществ, взятых в степенях, равных их коэффициентам, есть величина постоянная.
К показывает, во сколько раз скорость прямой реакции больше скорости обратной при данной температуре и концентрациях всех реагирующих веществ, равных 1 моль/л.
Как видно, константа равновесия есть отношение констант скорости прямой и обратной реакции.
Когда концентрации реагирующих веществ перестанут изменяться, то установится равновесие и V1= V2
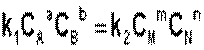 , или
, или
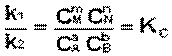
Физический смысл константы равновесия:
закон действующих масс:
«Если на систему, находящуюся в состоянии химического равновесия, оказывать внешнее воздействие (изменять температуру, давление, концентрации веществ), то положение равновесия смещается в такую сторону, чтобы ослабить внешнее воздействие».
(равновесие будет смещаться до тех пор, пока не устано-вится новое равновесие, соответствующее данным условиям)
- Увеличение давления (для газов) смещает равновесие в сторону реакции, ведущей к умень-шению объема (т.е. к образованию меньшего числа молекул).
2 NO(г) + Cl2(г) = 2 NOCl(г)
2.Увеличение температуры смещает положение равновесия в сторону эндотермической реакции (т.е. в сторону реакции, протекающей с поглощением теплоты)
3.Увеличение концентрации исходных веществ и удаление продуктов из сферы реакции смещает равновесие в сторону прямой реакции.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 524; Нарушение авторских прав?; Мы поможем в написании вашей работы!