
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
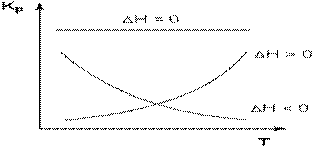
Зависимость константы равновесия от температуры
|
|
|
|
G=0 dG = 0, d2G > 0
ТЕРМОДИНАМИЧЕСКОЕ РАВНОВЕСИЕ
FeCl3 + 3NH4SCN Û Fe(SCN)3 + 3NH4Cl
Состояние системы с минимальной свободной энергией есть состояние термодинамического равновесия:
Изобарно-изотермические условия (P = const, T = const):
Термодинамическим равновесием называется такое состояние системы, которое при постоянстве внешних условий не изменяется во времени, причем эта неизменяемость не обусловлена каким-либо внешним процессом.
(химическое равновесие - частный случай термодинамического равновесного состояния.)
В общем виде условие химического равновесия (уравнение Гиббса – Дюгема) можно записать следующим образом: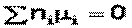
Подставив в него зависимость химического потенциала от концентрации, получаем:
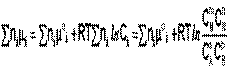
Для изобарно-изотермического процесса аналогичным образом можно получить выражение Изотермы химической реакции:
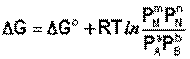
Если система находится в состоянии химического равновесия, то изменение ТД потенциала равно нулю (DG=0) получаем:
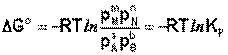
Здесь сi и рi – равновесные концентрации [Ci] и давления исходных веществ и продуктов реакции. Уравнение связывает константу равновесия со стандартным изменением энергии Гиббса в ходе реакции и позволяет ответить на вопрос, будет ли химическая реакция протекать самопроизвольно при данных концентрациях Сi (давлениях Рi) реагентов:
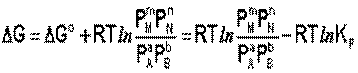
Направление химической реакции определяется по величине отношения:
1. Пс/ Kc = 1; DG = 0; =
2. Пс/ Kc < 1; DG < 0; ->
3. Пс/ Kc >1; DG >0; <-
Влияние температуры на положение равновесия получаем для зависимости константы равновесия от температуры уравнение– изобары Вант-Гоффа,
связывающую изменение константы химического равновесия с тепловым эффектом реакции:
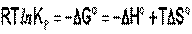
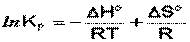
Продифференцировав выражение по температуре,
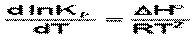
(чем больше по абсолютной величине тепловой эффект химической реакции, тем сильнее влияет температура на величину константы равновесия.)
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 905; Нарушение авторских прав?; Мы поможем в написании вашей работы!