
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Обратимые реакции. Хим равновесие. Закон действующих масс. Константы равновесия
|
|
|
|
Обратимыереакции — хим реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном), пр: 3H2+N2 ⇆ 2NH3 Направление обратимых реакций зависит от концентрац веществ.
Химическое равновесие – это динамическое состояние обратимых процессов, при которой скорость прямой реакции = скорости обратной реакции, а соотношение количеств реагентов и продуктов во времени не меняется.
ЗДМ - соотношение произведения равновесных концентраций с участием их стехиометрических коэф-ов, есть величина постоянная. Согласно Закону Действия масс скорость, с которой вещества реагируют друг с другом, зависит от их концентрации. VаА+VbB↔VcC+VdD
Константы равновесия Может быть записана через равновесные активности (а), равновесные концентрации (C), равновесные парциальные давления (p). nAA + nBB D nCC + nDD (1).
Для реакции (1): Ka = (aCn(C) * aDn(D)) / (aAn(A) * aBn(B)) — ТД константа равновесия.
KC = (CCn(C) * CDn(D)) / (CAn(A) * CBn(B)) — концентрационная константа равновесия.
Kp = (CCn(C) * CDn(D)) / (CAn(A) * CBn(B)) — константа равновесия для давлений.
Для разбавленных растворов используют константу, выраженную через концентрации. Для газовых реакций используют константу, выраженную через парциальные давления.
Внимание! Ka ¹ KС ¹ Kp. Под действием внешних факторов равновесные активности/концентрации/давления компонентов системы могут меняться, однако их соотношение, т. е. константа равновесия, всегда остаётся постоянной при данной температуре.
Итак, Ka ¹ KС ¹ Kp, Ka, KС, Kp = inv (T). K = 1: истинное равновесие; K > 1: равновесие смещено вправо; K < 1: равновесие смещено влево. DG = –RT * lnK. С
мещение равновесия подчиняется закону Ле-Шателье: Если на систему, находящуюся в равновесии, оказывается воздействие извне, то равновесие смещается в сторону, подавляющую это воздействие. Константа равновесия изменяется только при температурном воздействии.
|
|
|
Конст равнов -это хар-ка индивидуального процесса, завис от природы всех компонентов и t.
υаА+υbB↔υcC+υdD при равновесии скорость Vпр=Vобр
Vпр=К1*САυА* СBυB
Vобр= К2*Сcυc* СDυD
при равновесии К1*САυА* СBυB= К2*Сcυc* СDυD
К= Сcυc* СDυD/ САυА* СBυB=const – закон действ масс (при t=const)
В гомогенных сис-мах: газовые 2SO2 (г) +О2(г) = 2SO3 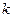 =
= 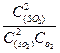 ;
;
в растворе 2NaОНр-р + Н2SO4 р-р→Nа2SO4 р-р+2 Н2О*
ОН- + Н +→Н2О 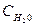 = const
= const  =
= 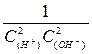
В гетерогенных сис-мах
Константа равновесия не включает жидкие и твердые вещ-ва. Их состояние можно принять за сос-е чистого вещ-ва, т.е. С - постоянная величина.
MgСО3(тв) Mg O(тв) + СО2(г) вещества К= С(СО2)
Mg O(тв) + СО2(г) вещества К= С(СО2)
Если в водном растворе, то Кр записывается для сокращенной ионно-молекулярной формы.
Выражения для константы равновесия записывают на основании уравнения химической реакции. При записи следует помнить, что:
1. Те компоненты, С которых в процессе не меняется, в выражение константы не входят Срастворителя , так как она >>С других компонентов, например если реакция идет в водном растворе, 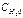 не меняется
не меняется
2. Твердые и жидкие вещества в гетерогенных реакциях обособленна от остальных компонентов физической границей раздела фаз. Их состояния можно принять за состояние чистого вещества., а Счистого вещества = const
3. Если в водном растворе, то Кравновесия записывается для сокращенной ионно-молекулярной формы.
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 666; Нарушение авторских прав?; Мы поможем в написании вашей работы!