
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Равновесие гидролиза солей. по катиону,по аниону, рН водных р-ров солей, константа гидролиза
|
|
|
|
Гидролиз –реакция обмена ионов с H2O. Гидролиз возможен в том случае, если среди продуктов образуются малодиссоциирующие вещества: слабые кислоты или основания.
Подвергаются соли, образованные слабой к-той и сильным основ, или слабым основ и сильной к-той или слабой к-той и слабым основ.
Количественно процесс гидролиза характеризуется h-степень гидролиза,
Кг – константа гидролиза. Гидролиз всегда протекает по иону от слабого электролита
Гидролиз по катиону. (гидролиз солей, образованных слабыми основ)
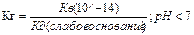 кислотная среда
кислотная среда
NH4Cl
NH4-слаб основание, Cl- сильная кислота
NH4+Cl- +H2O↔NH4OH+HCl
NH4++ H2O↔ NH4OH+H+ (pH<7)
Kг=[С(NH4OH)С(H+)/C(NH4+)]*[C(OH-)/C(OH-)=KB/KgNH4OH=10-14/1,7*10-5=5,8*10-10
Гидролиз по аниону. (гидролиз солей, обр слабыми кислотами)
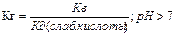 щелочная среда
щелочная среда
CH3COONa: CH3COO-слабая кислота, Na- сильн основание
CH3COO+Na-+ H2O↔CH3COO+Na OH; CH3COO-+ H2O↔ CH3COOH+ OH-(pH>7)
Kг=[С(CH3COOH)С(OH)/C(CH3COO-)]*[C(H+)/C(H+)=KB/Kg CH3COOH
рН водных растворов солей
KВ - константа ионного произведения воды
KВ=C(H+)C(OH-)= const (при T= const)
Значение KВ устанавливает взаимосвязь С ионов H+ и гидроксид OH – в водных растворах. По KВ можно определить среду воды и водного раствора: кислотная, щелочная KВ=10-14(при t=18оС)
Обозначения:
-lg C(H+)=рН – водородный показатель
-lg C(OH –)=рОН – гидроксидный показатель
-lg KВ= -lg 10-14=14; рН+ рОН=14; При гидролизе солей меняется рН водного раствора.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 394; Нарушение авторских прав?; Мы поможем в написании вашей работы!