
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Типичные восстановители
|
|
|
|
Типичные окислители.
1. Простые вещества – типичные неметаллы F2 (только ок-ль), O2, Cl2 (максим. ЭО) *галогены
2. Анионы- окислители – соединения, где велика степень окисления металла (степень окисления = № группы или близка к нему)
Mn+7O4 - (KMn+7O4), K2Cr2+6O7, K2Cr2O4
K2Mn+6O4
3. Катионы - окислители - Pb+4 (PbO2), Mn+4 (MnO2), Fe3+ (FeCl3),
Hg2+ (больш. недостаток).
4. Неметаллы в высоких степенях окисления – прежде всего к-ты: HN+5O3, H2S+6O4
HNO3 восстанавливается до разных степеней окисления азота. H2SO4 конц. в кач-ве ок-ля выступает S+6, в разбавленной Н+; KCl+7O4; KCl+5O3 – высок. ст.ок., Н2О2.
1. Металлы I и II групп главной подгруппы - Li – Fr, водород (Н2)
Другие простые в-ва могут быть и ок-ли и восст-ли (S).
Анионы – с миним. ст.ок. I - (HI), Cl - (HCl), Br – (HBr, KBr), S -2 (H2S), F -.
Катионы – маленькая степень окисления Mn+2,Fe+2, Sn+2(SnCl2), Cr+3 (Cr2(SO4))3.
NH3 является только восстановителем, т.к. N-3 (низшая степень окисления).
Например, три соединения Mn:
Mn+2SO4 - только восстановитель;
Mn+4O2 – в зависимости от условий реакции и окислитель и восстановитель;
KMn+7O4 – максимальная степень окисления, больше повышать ее не может =>только окислитель.
Классификация о-в р.
Выделяют 3 вида о-в р:
1.Межмолекулярные
Окислитель и восстановитель находятся в разных веществах.
Zn0+H+1 Cl→Zn+2Cl2+H02
2.Внутримолекулярные – реакции, в которых окислитель и восстановитель находятся в одном и том же веществе. Как правило, реакции разложения.
 (N-3 H4)2Cr+62O7 t N02+Cr+32O3+4H2O
(N-3 H4)2Cr+62O7 t N02+Cr+32O3+4H2O
N-3 – восстановитель;
Cr+6 – окислитель;
N -3H4N+5O3=N2+1 O+2H2O
(здесь атомы одного и того же элемента имеют разные степени окисления)
3.Реакции диспропорционирования (диспропорция – отсутствие пропорциональности, несоразмерность) или их еще называют реакциями самоокисления- самовосстановления. Реакции, когда атом одного и того же элемента является одновременно и окислителем и восстановителем. Эти реакции возможны для веществ, содержащих атомы с промежуточной степенью окисления.
2K2Mn+6O4(тем.зел.цвет)+2H2O=2KMn+7O4(фиолет.)+Mn+4O2↓(бурый)+4KOH
 Mn+6-1e- →Mn+7 2
Mn+6-1e- →Mn+7 2
Mn+6+2e- →Mn+4 1
4KCl+5O3 t 3KСl+7O4+KCl-1
Для того, чтобы расставить коэффициенты в О-В Р применяют 2 метода: метод электронного баланса и метод полуреакций.
Метод электронного баланса.
Сравнивают степени окисления атомов в исходных и конечных продуктах (веществах), руководствуясь тем, что число отданных электронов должно равняться числу принятых.
4HCl-1 конц.+Mn+4O2=Cl02↑+Mn+2Cl2+H2O
 2Cl- - 2e- →Cl02 1 Cl- - восстановитель
2Cl- - 2e- →Cl02 1 Cl- - восстановитель
Mn+4 +2e- →Mn+2 1 Mn+4 – окислитель
Проверку коэффициентов проводят, подсчитывая число атомов элементов в левой и правой частях уравнения, последним подсчитывают кислород.
8HI- +H2S+6O4 = 4I02 +H2S-2 +4H2O
 2I- - 2e- → I02 4 I-- восстановитель
2I- - 2e- → I02 4 I-- восстановитель
S+6 +8e- →S-2 1 S+6 – окислитель
Метод полуреакций или метод электронно-ионного баланса.
Этот метод показывает, что в реакциях принимают участие не атомы с той или иной степенью окисления, а ионы, находящиеся в растворе. Составляются частные уравнения реакций восстановления ионов окислителя и окисления ионов восстановителя. Для баланса атомов существуют свои помощники. В кислой среде Н+ и Н2О, в щелочной – ОН- и Н2О.
5H2S-2+2KMn+7O4+3H2SO4 = 2Mn+2SO4 +5S0↓+K2SO4+8H2O
0 2+
 H2S – 2e- →S0 + 2H+ 5
H2S – 2e- →S0 + 2H+ 5
MnO4 - + 8H+ +5e- →Mn2++4H2O 2
+7 +2
А теперь почленно складываем левые и правые части полуреакций, умножая при этом уравнения на соответствующие числа.
5H2S+2MnO4- +16H+→5S0+10H++2Mn2++8H2O
Сокращаем на 10Н+ и получаем:
5H2S+2MnO4- +6H+→5S0+2Mn2++8H2O
или
K2Cr+62O7+3H2S-2+4H2SO4=Cr+32(SO4)3+3S0↓+K2SO4+7H2O
12+ 6+
 Cr2O2-7 +14H+ +6e- →2Cr3++7H2O 1
Cr2O2-7 +14H+ +6e- →2Cr3++7H2O 1
H2S – 2e- → S0+2H+ 3
Cr2O2-7 +14H++3H2S →2Cr3++7H2O+3S0
Влияние среды на протекание реакции.
Реакции окисления-восстановления могут протекать в различных средах: В кислой (изб. H+), нейтральной (H2O), щелочной (изб. ОН-). В зависимости от среды может изменяться характер протекания реакции между одними и теми же веществами. Среда влияет на изменение степеней окисления атомов.
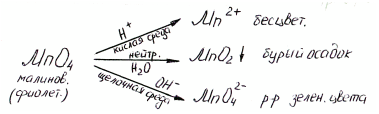
Обычно в качестве кислой среды выступает H2SO4, HNO3 не берут, т.к. является окислителем, HCl – т.к. способна окисляться. Для создания щелочной среды применяют растворы NaOH и КОН.
5Na2SO3+2KMnO4+3H2SO4 →5Na2SO4+2MnSO4+K2SO4+3H2O
 MnO-4+8H++5e-→Mn2++4H2O 2
MnO-4+8H++5e-→Mn2++4H2O 2
SO2-3 +H2O – 2e-→SO2-4+2H+ 5
2MnO2-4+16H++5SO2-3+5H2O → 2Mn +8H2O+5SO2-4 +10H+
2KMnO4 +Na2SO3+2KOH → 2K2MnO4+Na2SO4+H2O

MnO-4+1e- →MnO2-4 2
SO2-3 +2OH- -2e- →SO2-4 +H2O 1
2MnO-4 +SO2-3 +2OH-→2MnO2-4 +SO2-4+H2O
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 926; Нарушение авторских прав?; Мы поможем в написании вашей работы!