
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
R – универсальная газовая постоянная,
|
|
|
|
С — молярная концентрация раствора,
Т – абсолютная температура.
Осмотическое давление возрастает с увеличением концентрации растворенного вещества и температуры.
Уравнение Вант-Гоффа по форме записи соответствует уравнению состояния идеального газа
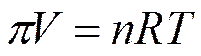 или
или 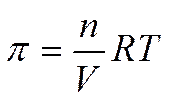 .
.
Проведя аналогию можно сказать, что осмотическое давление равно тому давлению которое оказывало бы растворенное вещество, если бы оно находилось в газообразном состоянии и занимало объем равный объему раствора.
Осмос играет очень важную роль в биологических процессах, обеспечивая поступление воды в клетки и другие структуры. Концентрированные растворы сахара (сироп) и соли (рассол) широко применяются для консервирования продуктов, так как вызывают удаление воды из микроорганизмов.
3 Применение законов Рауля и уравнения Вант-Гоффа к растворам электролитов
При экспериментальной проверке законов Рауля и уравнения Вант-Гоффа оказалось, что для ряда растворов экспериментальные значения были больше теоретических, нередко в несколько раз. Особенностью данных растворов было то, что они проводили электрический ток. Для применения к ним законов неэлектролитов необходимо вводить в соответствующие формулы поправочный, так называемый, изотоническим коэффициентом (i). Изотонического коэффициента показывает, во сколько раз число частиц в растворе (Nобщее) больше того, которое растворили (N0), т.е.
i = Nобщее/N0.
Для объяснения данных отклонений Аррениус в 1887 предложил теория электролитической диссоциации. В растворах электролитов происходит самопроизвольный распад – диссоциация молекул на ионы, в результате чего раствор становится электропроводным. Температуры кипения и замерзания растворов, осмотическое давление зависят не только от концентрации электролита, но и от степени его диссоциации (α).
Степень диссоциации – это отношение числа продиссоциировавших (Nдис) частиц к исходному числу частиц растворенного вещества (No
)
α = Nдис/No.
Для таких сильных электролитов как HCl, Ca(NO3)2, Cr(NO3)3 оказалось, что значения i составляют примерно соответственно 2, 3, 4. Из записи электролитической диссоциации данных соединений видно, что количества образующихся ионов согласуются с приведенными значениями i:
HCl ® H+ + Cl– i = 2,
Ca(NO3)2 ® Ca2+ + 2NO3– i = 3,
Cr(NO3)3 ® Cr3+ + 3NO3– i = 4.
Для слабых электролитов значения i были больше единицы, но не превышали два. Это объясняется частичной диссоциацией слабых электролитов.
Оказалось, что диссоциации подвергаются вещества с ионной, полярной или легко поляризуемой связями.
Важную роль в диссоциации играет растворитель. Одни и те же вещества проявляют свойства сильных электролитов в одних растворителях и слабых – в других. Так, например, в воде хлороводород – сильный электролит, а в бензоле – слабый. Гидроксиды щелочных металлов полностью диссоциируют в воде, но различаются по силе в спиртовых растворах. Чаще всего наибольшая степень диссоциации проявляется в растворителях с большой диэлектрической проницаемостью (ε), высокой сольватирующей способностью и малой вязкостью. К таким растворителям в первую очередь относится вода.
Механизм электролитической диссоциации согласуется со схемой приведенной на рисунке 2.
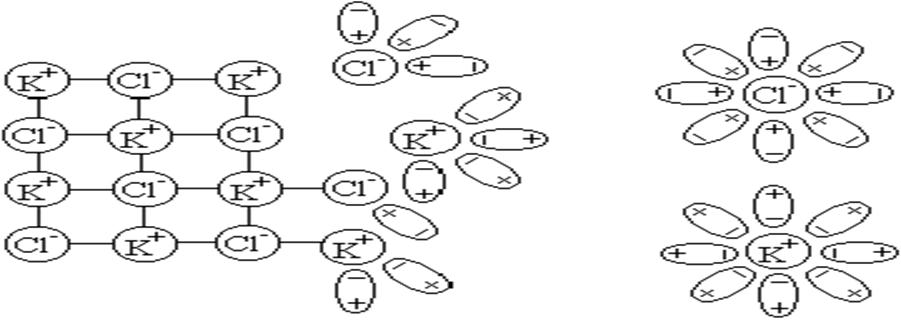
Рисунок 2 Схема растворения и диссоциации хлорида калия
Из данной схемы видно, что продукты диссоциации электролита (ионы) в результате электростатического взаимодействия с растворителем образуют сольваты или в случае воды – гидраты.
ЛЕКЦИЯ № 5
«РАСТВОРЫ ЭЛЕКТРОЛИТОВ»
1.Электролитическая диссоциация
Электролитическая диссоциация – это распад вещества на ионы под действием полярных молекул растворителя.
По способности распадаться на ионы электролиты делятся на сильные и слабые. Это различие носит принципиальный характер, так как для описания ряда свойств сильных и слабых электролитов применяются различные математические зависимости.
В соответствии с положением в периодической таблице элемента, образующего соответствующий электролит, к сильным электролитам относятся:
1) Основания – I-группа, II-группа начиная с Са(ОН)2
и III-группа Тl ОН;
2) Кислоты – V-группа НNО3, VI-группа Н2SО4 и Н2SеО4,
VII-группа НСl, НСlО4, НСlО3 и соответствующие кислоты для брома и йода;
3) Соли – все хорошо растворимые.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 743; Нарушение авторских прав?; Мы поможем в написании вашей работы!