
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Остальные электролиты, за немногим исключениям, относятся к слабым
|
|
|
|
1.1 Диссоциация сильных электролитов
Сильные электролиты диссоциируют необратимо и практически полностью.
В уравнении диссоциации ставят знак «®» (односторонний не равновесный процесс). Примеры диссоциации основных классов неорганических соединений:
Ca(OH)2 ® Ca2+ + 2OH–,
H2SO4 ® 2H+ + SO42–,
Cr2(SO4)3 ® 2Cr3+ + 3SO42–.
Концентрацию ионов в растворах сильных электролитов рассчитывают по уравнениям их диссоциации.
Для точных расчетов необходимо находить активную (или проявляющую себя в действии) концентрацию (а), вычисляемую по формуле
а = f·С,
где, а – активная концентрация,
f – коэффициент активности,
С – аналитическая концентрация.
1.2 Диссоциация слабых электролитов
Слабые электролиты диссоциируют обратимо и ступенчато.
Для характеристики диссоциации слабых электролитов применяется константа диссоциации (Кд) и степень диссоциации (α).
При диссоциации слабых электролитов устанавливаются равновесные концентрации между ионами – продуктами диссоциации и не распавшимися молекулами (или сложными ионами). Данные равновесия подчиняются закону действующих масс и количественно выражаются через Кд. Обратимость в уравнении диссоциации отражают знаком ««» – обратимый равновесный процесс. Например, для диссоциации водного раствора аммиака
NH4ОH «NH4+ + OH–, Kд = 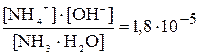 .
.
Константа диссоциации количественно характеризует силу электролита. Чем слабее электролит, тем меньше константа диссоциации.
В случае многозарядных слабых электролитов диссоциация протекает ступенчато.
Например, для ортофосфорной кислоты:
I-ступень – H3PO4 «H+ + H2PO4– Кд1= 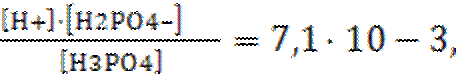
II-ступень – H2PO4– «H+ + HPO42– Кд1= 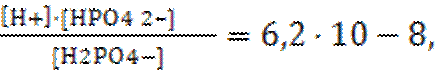
III-ступень – HPO42– «H+ + PO43– Кд1= 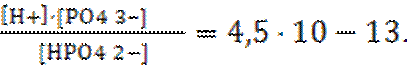
Константы диссоциации слабых электролитов приводятся в справочниках. В практических расчетах, не требующих высокой точности, достаточно учитывать диссоциацию по первой ступени, так как последующие константы диссоциации примерно на пять порядков меньше.
2 Закон разбавления Оствальда
Выведем закон разбавления Оствальда, который устанавливает математическую связь между Кд, α и С(электролита). Вывод проведем на примере диссоциации уксусной кислоты
СH3СООН «H+ + СН3СООA–.
Обозначим:
С − исходная концентрация кислоты, тогда
αС – равновесные концентрации ионов,
Сравн. = (1-α)С − равновесная концентрация кислоты.
Подставив эти обозначения в выражение константы диссоциации, получим следующее уравнение для расчета степени диссоциации
 Кд =
Кд =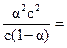
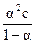 .
.
Если α << 1, то в полученном уравнении можно считать, что (1 – α)» 1. Тогда
Kд = α2с и 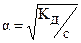 .
.
Так как степень диссоциации обратно пропорциональна корню квадратному из концентрации, то с разбавлением раствора степень диссоциации растет. Эта зависимость называется законом разбавления Оствальда.
Выведем формулу для расчета равновесной концентрации ионов водорода в растворе одноосновной слабой кислоты.
Так как в ходе диссоциации образуются одинаковые концентрации ионов водорода и анионов кислоты, то выражение Кд можно записать следующим образом
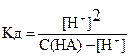 .
.
Если электролит очень слабый, то [H+] << с(HA), и величиной [H+] в знаменателе можно пренебречь. Тогда получаем упрощенные уравнения:
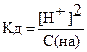 => [H+] =
=> [H+] = 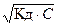 .
.
Для слабых оснований формула имеет подобный вид.
3 pH водных растворов
3.1 Ионное произведение воды
Запишем уравнение диссоциации воды H2O «H+ + OH– .
Отсюда выражение константа равновесия (константа диссоциации воды) имеет вид
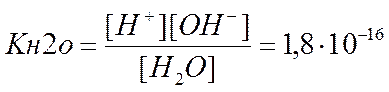 .
.
Из величины константы диссоциации воды следует, что степень диссоциации воды очень мала и поэтому можно считать, что [H2O]» C(H2O) = 1000/18 = 55,6 моль/л.
Тогда KH2O» [H+][OH–]» 1,8·10–16·55,6» 1·10–14 (при 25 0С)
.
Произведение [H+][OH–] является постоянной величиной, которую называют ионным произведением воды.
Из ионного произведения воды следует, что концентрации ионов H+ и OH– взаимосвязаны, поэтому для характеристики среды можно использовать концентрацию только одного иона. На практике используется концентрация ионов Н+.
В чистой воде [H+] = 10–7 моль/л,
в растворах кислот [H+] > 10–7 моль/л,
в растворах оснований [H+] < 10–7 моль/л.
3.2 Формула для вычисления рН-растворов
Концентрации ионов H+ и OH– могут меняться в очень широких пределах, поэтому в расчетах удобнее использовать не значения концентраций, а их логарифмы (lg). Отсюда получаем
рН = -lg[H+].
Значок «p» обозначает математическую операцию «-lg», а [H+] – молярную концентрацию ионов водорода.
рН – это отрицательный десятичный логарифм из молярной концентрации ионов водорода.
3.3 Примеры расчетов рН в растворах сильных и слабых кислот и оснований:
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 457; Нарушение авторских прав?; Мы поможем в написании вашей работы!