
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Образование осадков
|
|
|
|
Образование газообразных веществ
2К2СО3 + Н2SО3 ↔ Н2СО3 + К2SО3,
2К+ + СО32- + Н2SО3 ↔ Н2СО3 + 2К+ + SО32-,
СО32- + Н2SО3 ↔ Н2СО3 + SО32-.
В исходных веществах и продуктах реакции содержатся слабые термически нестойкие кислоты, при разложении которых образуются соответственно СО2 и SО2. Равновесие будет смещаться в сторону прямой реакции, так как константа диссоциации угольной кислоты (Кд1=4,5·10-7) меньше чем у сернистой кислоты (Кд1=1,3·10-2). Дополнительным фактором смешения равновесия в сторону прямой реакции является большая термическая нестойкость угольной кислоты.
KI + AgCl¯ ↔ KCl + AgI¯,
K+ + I- + AgCl¯ ↔ K++ Cl- + AgI¯,
I- + AgCl¯ ↔ Cl- + AgI¯.
Для прогнозирования смещения равновесия в данной реакции необходимо сравнить произведения растворимостей, образующихся осадков. Из значений ПР(AgCl) = 1,8· 10-10 и ПР(AgI) = 1,0·10-16 следует, что равновесие будет практически полностью смещено в сторону прямой реакции, т.е. в сторону образования менее растворимого осадка.
4) Образование комплексных соединений
К4[Cо(СN)6] + 6NH3 «[Cо(NH3)6](СN)2 + 4КСN,
4К+ + [Cо(СN)6]4- + 6NH3 «[Cо(NH3)6]2+ + 6СN- + 4К+,
[Cо(СN)6]4- + 6NH3 «[Cо(NH3)6]2+ + 6СN-.
Из сравнения значений констант нестойкостей ионов Кн([Cо(СN)6]4-) =
1,2·10-19 -и Кн([[Cо(NH3)6]2+)=2,5·10-4 следует, что равновесие будет практически полностью смещено влево, так как цианидный комплекс кобальта значительно более прочный чем аммиачный
3 Гетерогенные равновесия в растворах электролитов.
Произведение растворимости
Для количественной характеристики системы осадок – раствор применяется произведение растворимости (ПР) – постоянная величина зависящая только от температуры.
Вывод ПР для бинарного электролита проведем на примере раствора с осадком АgСl.
В системе осадок раствор устанавливается равновесие
АgСl ¯ 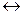 АgСl (р-р)
АgСl (р-р) 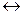 Аg + + Сl–.
Аg + + Сl–.
Применив закон действующих масс к данной гетерогенной системе, получим следующее выражение константы равновесия
Кр = 

ПР(АgСl) = [Аg +]× [Сl–] = 1,8· 10-10(25 0С).
Если обозначить концентрации ионов через S, то в общем виде формула для вычисления ПР бинарного электролита имеет вид
ПР = S2,
где S – молярная растворимость осадка.
Молярная растворимость для бинарного электролита вычисляется соответственно по формуле
S = ÖПР(x).
Значения ПР малорастворимых электролитов приводятся в справочной литературе.
Для электролитов диссоциирующих на три ион (например, СаF2↔ Са2+ + 2F- и др.) математическая зависимость для ПР и S имеют вид
ПР = 4S3 отсюда S =  .
.
Для электролитов диссоциирующих на четыре и более ионов будут более сложные математические зависимости. Поэтому по значениям ПР можно сравнивать растворимость только однотипных электролитов.
ЛЕКЦИЯ № 7
«Гидролиз солей»
1 Общие представления о гидролизе
Гидролиз - это обменная реакция взаимодействия вещества с водой. Гидролизу подвергаются вещества различных классов неорганических и органических соединений. Важным частным случаем гидролиза является гидролиз водных растворов солей.
Разберем процессы, происходящие при гидролизе, на примере ацетата натрия. При растворении соли в воде происходит её диссоциация на катионы и анионы
СН3СООNа → Nа+ + СН3СОО-.
Образующиеся ионы взаимодействуют с полярными молекулами воды с образованием сильного основания (NаОН) и слабой кислоты (СН3СООН). Это приводит к связыванию ионов водорода и к появлению избытка гидроксид ионов
СН3СОО- + Н+ОН- ↔ СН3СООН + ОН-.
Реакция среды в данном случае щелочная.
Таким образом гидролиз – это ионообменная реакция соли с водой в результате которой изменяется рН-раствора.Так как в процессе гидролиза образуются кислота и основание можно считать, что гидролиз это реакция обратная реакции нейтрализации.
Соли, образованные сильной кислотой и сильным основанием (NаСl и др.), гидролизу не подвергаются, так как образующиеся при диссоциации ионы не взаимодействуют с водой с образованием слабых электролитов.
2 Различные случаи гидролиза
Для описания гидролиза будем применять сокращенную фирму записи, включающую диссоциацию соли и взаимодействие с водой только тех ионов, которые приводят к гидролизу.
Примеры различных случаев гидролиз:
1) Гидролиз соли образованной слабым основанием и сильной кислотой
NH4CI → NH4+ + СІ-,
NH4+ + НОН ↔ NH4OH + Н+, рН< 7.
Гидролиз протекает по катиону, реакция среды кислая.
2) Гидролиз соли образованной сильным основанием и слабой кислотой
NaNО2 → Na+ + NO2-,
NO2- + НОН ↔ НNО2 + OН-.
Гидролиз протекает по аниону, реакция среды щелочная.
3) Гидролиз соли образованной слабым основанием и слабой кислотой
NH4NО2 → NH4+ + NO2-,
NH4+ + NO2-+НОН ↔ NH4OH + НNО2, рН< 7.
Гидролиз протекает как по катиону так и по аниону, реакция среды кислая так как, константа диссоциации слабой кислоты (Кд(НN02) = 6,2 10-4) больше константы диссоциации слабого основания(Кд(NH4OH) =1,8·10-5).
Гидролиз большинства солей протекает незначительно, так как образующиеся в результате гидролиза слабые кислоты и основания обычно являются гораздо более сильными электролитами, чем вода. В большей степени гидролизуются соли образованные слабой кислотой и слабым основанием, а в случае солей содержащих многозарядные катионы и анионы может происходить полное разложение соли. Образуются в ходе гидролиза газообразные или малорастворимые соединения приводят к усилению гидролиза.
4) Гидролиз солей, образованных многозарядными катионами и анионами
Гидролиз солей, образованных многозарядными катионами и анионами, протекает ступенчато, при этом в качестве промежуточных продуктов гидролиза образуются основные соли, если гиролиз идёт по катиону, или кислые соли, если гидролиз идёт по аниону.
Na3PО4 → 3Na+ + PО4-3,
PО4-3 + НОН ↔ HPО4-2 + OH-, I-ступень,
HPО42- + НОН ↔ H2PО4- + OH-, II-ступень,
H2PО4- + НОН ↔ H3PО4+ OH-, III-ступень.
В большинстве случаев наиболее сильно процесс гидролиза протекает по первой ступени, поэтому в практических расчетах вторую и последующие ступени гидролиза обычно не учитывают.
5) Совместный гидролиз двух солей, образованных слабой кислотой и слабым основанием
При смешивании водных растворов двух солей, одна из которых образована катионом слабого основания, а другая - анионом слабой кислоты, происходит взаимное усиление гидролиза этих солей. Если кислота и основание, образующие эти соли, не только слабые электролиты, но и малорастворимые или разлагающиеся с образованием летучих продуктов, то гидролиз часто протекает необратимо. При этом образуются конечные продукты гидролиза - слабое основание и слабая кислота.
Совместный гидролиз хлорида алюминия и сульфида натрия
2 АlСІ3 + 3 Na2S + 6 НОН ↔ 2 А1(ОН)3 + 3 H2S + 6 NaCl,
2 Al3+ + 3 S2- + 6 НОН ↔ 2 А1(ОН)3 + 3 H2S.
В данном случае гидролиз протекает до образования конечных продуктов.
3 Гидролиз кислых солей
В случае гидролиза кислых солей параллельно с процессом гидролиза идет процесс диссоциации кислых ионов, содержащихся в кислотном остатке аниона кислоты. Реакция среды определяется тем, какой процесс преобладает. Эго можно выяснить, сравнив константы гидролиза и диссоциации анионов кислой соли.
Пример гидролиза дигидроортофосфата натрия
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 439; Нарушение авторских прав?; Мы поможем в написании вашей работы!