
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакция горения этана выражается термохимическим уравнением
|
|
|
|
Тепловой эффект химической реакции равен разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ (с учетом стехиометрических коэффициентов в виде соответствующих множителей)
Разберем данный вопрос на примере образования из простых веществ углекислого газа. Данное превращение можно провести по реакции
Закон Гесса
В основе термохимических расчетов лежит закон Гесса (1840 г) – тепловой эффект реакции зависит только от состояния исходных веществ и конечных продуктов, но не зависит от количества стадий перехода исходных веществ в продукты реакции.
С(кр) + O2(г) = СО2(г), 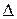 H10 = – 393,5 кДж/моль.
H10 = – 393,5 кДж/моль.
Или через промежуточный продукт (СО) в две реакции:
С(кр) + ½O2(г) = СО(г), 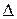 H10 = – 110,5 кДж/моль,
H10 = – 110,5 кДж/моль,
СО(г) + ½O2(г) = СО2(г), 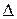 H10 = – 283,0 кДж/моль.
H10 = – 283,0 кДж/моль.
Из приведенных значений тепловых эффектов видно, что независимо от того, в одну или в две реакции осуществляется данное превращение, суммарный тепловой эффект одинаков и составляет 393,5 5 кДж/моль.
На практике широко используется следствия из закона Гесса:
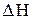 реакции = S ni DНобр. продуктов - S nj DНисх. веществ.
реакции = S ni DНобр. продуктов - S nj DНисх. веществ.
2) Тепловой эффект реакции равен разности между суммой энтальпий сгорания исходных веществ и суммой энтальпий сгорания продуктов реакции (с учетом стехиометрических коэффициентов в виде соответствующих множителей). его обычно применяют для реакций органических соединений)
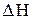 реакции = S nj DНсгорания исх. веществ -S ni DНсгорания обр. продуктов.
реакции = S nj DНсгорания исх. веществ -S ni DНсгорания обр. продуктов.
Закон Гесса и его следствия можно применять не только для химических превращений, но и для расчета тепловых эффектов фазовых переходов: плавления, кипения, кристаллизации, растворения и др.
Имея справочные или экспериментальные значения по теплотам образования (или сгорания) веществ, можно рассчитать тепловой эффект химической реакции. В таблице 1 приведены значения энтальпий образования некоторых веществ.
Таблица 1 – Стандартные энтальпии образования (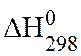 ) некоторых веществ
) некоторых веществ
| Вещество | Состояние | 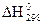 ,
кДж/моль ,
кДж/моль
| Вещество | Состояние | 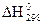 ,
кДж/моль ,
кДж/моль
|
| CH4 | г | -74,85 | Н2О | ж | -285,84 |
| C2 H6 | г | -84,67 | Н2О | г | -241,83 |
| C2 H2 | г | +226,75 | СО | г | -110,52 |
| C2 H4 | г | +52,28 | СО2 | г | -393,51 |
| C6 H6 | г | +82,93 | Са(ОН)2 | к | -986,50 |
| NH3 | г | -46,19 | Fe2О3 | к | -822,10 |
Примеры расчета тепловых эффектов химических реакций:
С2Н6(г) + 31/2О2 = 2СО2(г) + ЗН2О(ж), DН0298 = -1559,87 кДж.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 2105; Нарушение авторских прав?; Мы поможем в написании вашей работы!