
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Применим следствие из закона Гесса
|
|
|
|
Подставляя табличные значения, получаем
Применим следствие из закона Гесса
Вычислите энтальпию (теплоту) образования этана.
Решение:
DН0298 = [2DН0 298(СО2) + 3DН0298(Н2О)] - [DН0298(С2Н6) + 31/2DН0298(О2)]
DН0298(С2Н6) = 2(-393,51) + 3(-285,84) + 1559,87 = -84,67 кДж/моль
Ответ: DН0298(С2Н6) = -84,67 кДж.
2) Рассчитать количество тепла, необходимое для испарения 1 м3 воды.
Решение:
Запишем уравнение фазового перехода H2O(ж) = H2O(г).
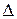 Н 0298 исп. (Н2О 2Ож) =
Н 0298 исп. (Н2О 2Ож) = 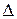 H0 298(Н2О г)–
H0 298(Н2О г)– 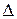 H0 (Н2О ж)= –242 – (–286) = 44 кДж/моль.
H0 (Н2О ж)= –242 – (–286) = 44 кДж/моль.
Для испарения 1 м3 (5,56·104 моль) воды потребуется 44·5,56·104 = =2,42·106 кДж.
На примере реакции нейтрализации покажем методику проведения экспериментальных расчетов тепловых эффектов химических реакций.
Реакции нейтрализации относится к наиболее распространенным в химии реакциям. Они протекают при взаимодействии кислот с основаниями.
Рассмотрим данную реакцию на примере взаимодействия сильной кислоты с сильным основанием.
Молекулярная форма – HCl + NaOH = NaCl + H2O,
полная ионная форма – H+ + Cl– + Na+ + OH– = Na+ + Cl– + H2O,
сокращенная ионная форма – H+ + OH– = Н2O.
Таким образом, все реакции между сильными кислотами и основаниями имеют общую сокращенную ионную форму.
Термохимическое уравнение данной реакции имеет вид
H+(p) + OH–(p) = H2O(ж), DН0 298 = -57,2 кДж/моль.
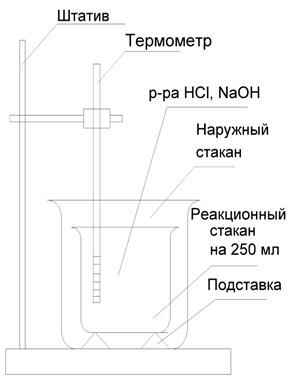 Экспериментальная проверка теплового эффекта данной реакции проводится на калориметрическая установка, наиболее простой вариант которой приведен на рисунке 1.
Экспериментальная проверка теплового эффекта данной реакции проводится на калориметрическая установка, наиболее простой вариант которой приведен на рисунке 1.
Во внутреннем стакане калориметра проводят реакцию между растворами кислоты и щелочи. Растворы должны иметь одинаковую температуру с калориметром и окружающей средой.
В ходе реакции выдаляется энергия, которая расходуется на нагрев содержимого калориметра, в результате чего его температура повышается. Вычислив изменение температуры (∆t) и зная теплоемкости всех частей калориметра или постоянную калориметра можно найти количество выделившейся энергии.
Рисунок 1 Схема калориметрической установки
Для получения точных результатов необходимо применять специальную калориметрическую установку.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 403; Нарушение авторских прав?; Мы поможем в написании вашей работы!