
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энергия Гиббса
|
|
|
|
Движущая сила процесса складывается из двух сил: стремления к упорядочению (DН) и стремления к беспорядку (TDS).
При p и T = const общую движущую силу процесса обозначают DG и вычисляют по формуле
DG = DH - TDS.
Величина G называется изобарно-изотермическим потенциалом или энергией Гиббса. Итак, мерой химического сродства является убыль энергии Гиббса (DG), которая зависит от природы вещества, его количества и от температуры. Энергия Гиббса является функцией состояния, поэтому
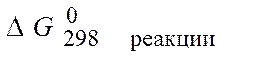 =
= .
.
Вычислив изменение DG в ходе процесса, можно сделать следующие выводы:
DG < 0 – самопроизвольно протекает прямой процесс,
DG > 0 – самопроизвольно протекает обратный процесс,
DG = 0 –состояние равновесия.
В таблица 3 приведены стандартные значения энергии Гиббса ( ) образования некоторых веществ
) образования некоторых веществ
Таблица 3 – Стандартные значения энергии Гиббса ( ) образования некоторых веществ
) образования некоторых веществ
| Вещество | Состояние | DG°298, кДж/моль | Вещество | Состояние | DG°298, кДж/моль |
| СО | г | -137,27 | Н2О | г | -228,59 |
| СО2 | г | -394,38 | Н2О | ж | -237,19 |
| FeO | к | -244,3 | NO2 | г | +51,84 |
| Fe3O4 | к | -1014,2 | СН4 | г | -50,79 |
| ВаО | к | -528,4 | С2Н2 | г | +209,20 |
Пример
Вычислить DН0298, DS0298, DG°т реакции, протекающей по уравнению:
Fe2O3(к) + ЗС(к) = 2Fe(к) + ЗСО(г).
Возможна ли реакция восстановления Fе2О3 углеродом при температурах 500 и 1000 К?
Решение. DН0298, DS0298 являются функциями состояния, поэтому находим их, используя математическое выражение следствия из закона Гесса:
DН0298 = 3(-110,52) + 2×0 - (-822,10 + 3×0) = -331,56 + 822,10 = +490,54 кДж,
DS0298 = (2×27,2 + 3 ×197,91) - (89,96 + 3×5,69) = 541,1 Дж/К.
Энергию Гиббса при соответствующих температурах находим из соотношения DG°t = DН0298 - TDS0298:
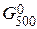 = 490,54 – 500×541,1/1000 = +219,99 кДж,
= 490,54 – 500×541,1/1000 = +219,99 кДж,
 = 490,54 – 1000×541,1/1000 = -50,56 кДж.
= 490,54 – 1000×541,1/1000 = -50,56 кДж.
Так как 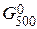 > 0, a
> 0, a  < 0, то восстановление Fе2О3 углеродом возможно при 1000 К и невозможно при 500 К.
< 0, то восстановление Fе2О3 углеродом возможно при 1000 К и невозможно при 500 К.
Термодинамические величины (U, Н, S, G) являются функциями состояния, поэтому изменение их в ходе процесса можно вычислять используя математические выражения следствий из закона Гесса. При решении задач следует учитывать, что как правило ΔU, DН и DG выражают в кДж, а S – в Дж.
Зная значению DG0т можно найти константу равновесия из формулы: DG0т = – R·T·lnKp.
ЛЕКЦИЯ № 13
«ХИМИЧЕСКАЯ КИНЕTИКА»
Химическая кинетика – учение о скоростях и механизмах протекания химических реакций.
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 455; Нарушение авторских прав?; Мы поможем в написании вашей работы!