
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Физические свойства галогенов
|
|
|
|
Рис. 1 Энергетические диаграммы валентных зон галогенов
1, 3, 5, 7.
Галогены проявляют нечетные валентности
Электронное строение и общая характеристика VII группы (галогены)
Р-ЭЛЕМЕНТЫ VII и VIII ГРУПП
Селен. Теллур
Селен по свойствам близок к сере. Селеновая кислота (Н2SеO4) также является сильной кислотой. Теллуровая кислота (Н2ТеO4) же кислота является очень слабой кислотой. Все соединения селена и теллура ядовиты.
Селен и теллур – полупроводники. Теллур служит легирующей добавкой к свинцу, улучшая его механические свойства.
ЛЕКЦИЯ № 20
«Р-ЭЛЕМЕНТЫ VII и VIII ГРУПП. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ»
В главную подгруппу VII группы входят элементы:
фтор (F), хлор (l), бром (Вr), йод (I) и астат (Аt). У атомов галогенов во внешнем электронном слое находится по семь электронов – ns2np5.
На рисунке 1 приведены энергетические диаграммы валентных зон галогенов в основном и возбужденных состояниях из которых видно, что фтор одновалентен, а остальные
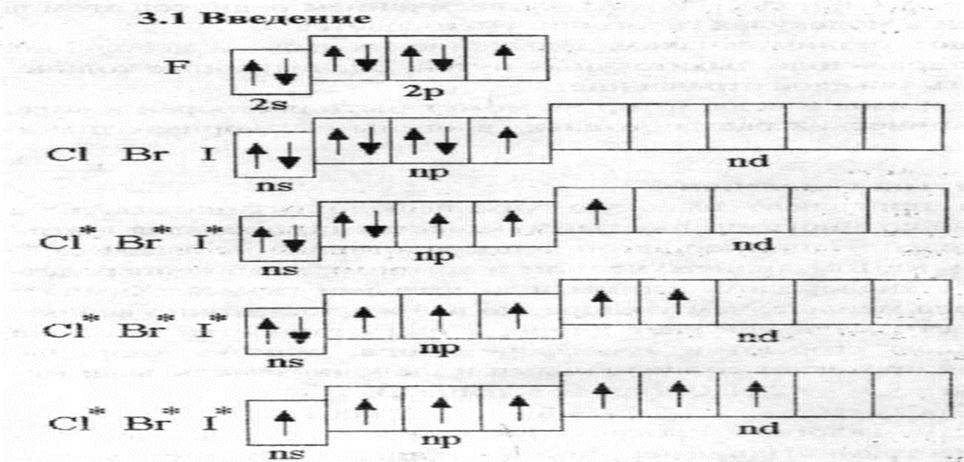
Каждый галоген в своей подгруппе является наиболее сильным окислителем. С повышением порядкового номера элементов в ряду F, С1, Br, I и At уменьшается окислительная способность элементов.
Фтор – проявляет только степень окисления -1.
С1,Br,I–проявляет степени окисления:-1, 0, +1, +3, +5, +7.
Фтор – газ бледно-жёлтого цвета;
Хлор – газ жёлто-зелёного цвета;
Бром – красно-бурая жидкость;
Йод – кристаллическое вещество темно-фиолетового цвета. При нагревании йод сублимируется (возгоняется), превращаясь в пар фиолетового цвета; при охлаждении пары йода кристаллизуются, минуя жидкое состояние.
|
|
|
Молекулы простых веществ двухатомны:
F2, С12, Br2, I2.
Галогены слабо растворимы в воде, но значительно лучше в органических растворителях. Фтор нельзя растворить в воде, так как он окисляет её
F2+ 2Н2O = 4НF + О2.
При растворении хлора в воде происходит его частичное (примерно на 1∕3) самоокисление-самовосстановление по реакции
С12 + Н2O ↔ НС1+ НС1О.
Полученный раствор называется хлорной водой. Он обладает сильными кислотными и окислительными свойствами и применяется для обеззараживания питьевой воды.
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 472; Нарушение авторских прав?; Мы поможем в написании вашей работы!