
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Водородные соединения галогенов
|
|
|
|
Химические свойства галогенов
Галогены проявляют высокую химическую активность. Они вступают во взаимодействие с многими простыми веществами, проявляя свойства окислителей. Самый активный неметалл фтор непосредственно не взаимодействует только с кислородом, азотом, гелием, неоном и аргоном; хлор непосредственно не взаимодействует с кислородом, азотом и инертными газами. Бром и йод химически менее активны. Многие металлы сгорают в атмосфере хлора, образуя хлориды:
2Na + С12 → 2NaCl (яркая вспышка);
Сu + С12 → СuС12;
2Fe + 3Сl2 → 2FeCl3.
Фтор со многими неметаллами реагирует с взрывом:
Н2 + F2 → 2HF; Si + 2F2 → SiF4; S + 3 F2 → SF6.
В его атмосфере фтора горят такие устойчивые вещества, как стекло и вода:
SiО2 + 2F2 → SiF4 + О2, 2Н2О+ 2F2 → 4HF +О2.
Окислительная активность галогенов уменьшается от фтора к астату, а восстановительная активность галогенид-ионов в этом направлении увеличивается. Из этого, что более активный галоген вытесняет менее активный из растворов его солей.
С12+ 2NaI → I2+ 2NaCl,
Вг2+ 2NaI → I2+ 2NaBr,
Cl2+ 2NaBr → Br2 + 2NaCl.
Водородные соединения представляют собой кислоты:
HF - фтороводородная (плавиковая) кислота,
НС1 - хлороводородная кислота (водный раствор – соляная),
НВг - бромоводородная кислота, HI - йодоводородная кислота.
НF должна быть одной из самых сильных кислот, но вследствие водородной связи является слабой кислотой Н–F·····Н–F·····Н–F.
Подтверждением водородной связи между молекулами Н–F является аномально высокая температура кипения Н–F. На рисунке 2 приведена графическая зависимость температур кипения кислот галогенов от их мольной массы.
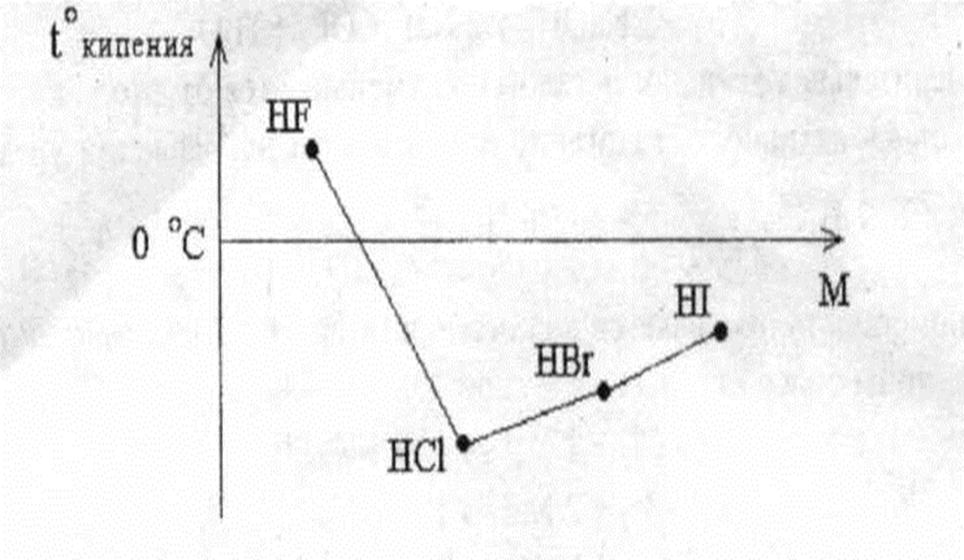
Рисунок 2. Зависимость температур кипения водородных кислот галогенов от их мольной массы
Плавиковая кислота реагирует с SiО2, входящим в состав стекла, поэтому HF нельзя получать и хранить в стеклянной посуде
SiО2 + 4 HF(ra3) = SiF4↑ + 2Н2О.
Образующийся SiF4 реагирует с избытком HF с образованием гексафторокремниевой кислоты:
SiF4 + 2 HF = H2[SiF6].
НСI, НВг, HI – сильные кислоты.
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 983; Нарушение авторских прав?; Мы поможем в написании вашей работы!