
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Квантовая теория атома
Уравнение Шредингера. Волны де Бройля описывают состояние только свободной частицы. В 1926 г. Э.Шредингер обобщил гипотезу де Бройля на случай движения микрочастицы во внешнем силовом поле и получил уравнение, описывающее поведение (распространение) волн вероятности во внешних силовых полях. Это уравнение, в результате решения которого получается конкретный вид ВФ, получило название волнового уравнения,или уравнения Шредингера
Волновые свойства микрочастиц. Корпускулярно-волновой дуализм присущ не только свету, но и частицам вещества. Эту идею высказал, исходя из соображений симметрии, Луи де Бройль: если свет, который рассматривался как электромагнитная волна, может проявлять корпускулярные свойства, то и частицы вещества должны проявлять волновые свойства.
Согласно этой идее, импульс частицы с массой m и скоростью υ равен р = mυ, а с другой стороны, он равен p= h/λ. Следовательно, движущейся частице можно поставить в соответствие волну с длиной: λБ = h/p = h/mυ.
Величину λБ называют дебройлевской длиной волны частицы. Экспериментально волновые свойства микрочастиц были обнаружены в опытах по дифракции электронов на кристаллах.
Наличие волновых свойств у частиц вносит ограничения в применимости к ним классической механики, согласно которой частица в любой момент времени занимает определенное положение в пространстве и обладает определенным импульсом.
Когда проводится какое-либо измерение, его результат содержит некоторую неопределенность, обусловленную двумя факторами: корпускулярно-волновым дуализмом и неизбежным взаимодействием наблюдаемого объекта с регистрирующим прибором, приводящим к изменению состояния объекта. Поэтому существует предел, ограничивающий точность измерений. Этот предел не зависит от степени совершенства измерительного прибора, а присущ самой природе вещей. Это и есть принцип неопределенностей Гейзенберга.
Количественные соотношения, выражающие этот принцип для конкретных динамических переменных, называются соотношениями неопределенностей. Наиболее важными являются два из них:
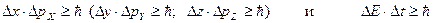 .
.
Первое соотношение утверждает, что нельзя измерить одновременно с абсолютной точностью положение (координату) и проекцию импульса микрочастицы на ту же ось. Чем точнее мы пытаемся определить положение объекта, т.е. чем меньше Δ х, тем больше будет неопределенность импульса Δ рx. Этот вывод можно понять из следующих рассуждений: пусть мы хотим как можно точнее узнать положение микрочастицы (Δ х→0). Для этого мы должны использовать фотоны с малой длиной волны λ (именно λ определяет точность измерения положения ∆х) и, соответственно, большим импульсом рf = h/λ. В результате такого соударения двух частиц измеряемая частица приобретает непредсказуемый импульс. Если же мы попытаемся точно измерить проекцию импульса, то большой окажется неопределенность в положении объекта. Принцип неопределенностей в то же время не запрещает точно определить что-то одно: либо положение, либо импульс. Можно также с абсолютной точностью измерить координату и проекции импульса на другие оси. Согласно этому соотношению неопределенностей: а) объяснена устойчивость атома; при гипотетическом падении электрона на ядро неопределенность положения электрона уменьшилась бы на 5 порядков с 10 –10 м (размер атома) до 10 –15 м (размер ядра). На 5 порядков соответственно увеличилась бы неопределенность импульса электрона и он, получив бы такую энергию, не смог бы удержаться в ядре; б) невозможно определить траекторию движения микрочастицы (для этого необходимо знать в каждый момент времени абсолютно точно и координату и импульс частицы);
Второе соотношение устанавливает связь между неопределенностью энергии Δ E квазистационарного возбужденного состояния и средним временем жизни Δ t возбужденного состояния в атомных процессах. Например, достаточно точно можно измерить энергию системы в стационарном состоянии, время жизни в котором велико (Δ t → ∞), если же система находится в нестационарном состоянии, время жизни Δ t в котором конечно, энергию можно измерить с погрешностью порядка Δ E ~ ħ /Δ t.
Волновая функция, физический смысл и свойства. Состояние квантовой частицы нельзя определять, как в классической механике одновременным заданием в каждый момент времени координат и импульса. Это запрещено принципом неопределенностей. По аналогии с электромагнитной волной, для которой электромагнитное поле определяется заданием некоторой функции координат и времени E(x,y,z,t), для описания движения микрочастиц вводится некоторая функция координат и времени Ψ(x,y,z,t), характеризующая волну де Бройля, и получившая название волновой функции (ВФ).
Сама волновая функция Ψ в общем случае комплексна и поэтому не имеет наглядного физического представления, ее нельзя продемонстрировать экспериментально. Согласно М.Борну, физический смысл имеет квадрат модуля ВФ 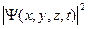 , с помощью которого определяется вероятность dP того, что частица в момент времени t будет обнаружена в элементе объема dV, расположенном в окрестности точки х, у,z:
, с помощью которого определяется вероятность dP того, что частица в момент времени t будет обнаружена в элементе объема dV, расположенном в окрестности точки х, у,z: 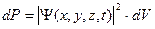 .
.
Т.о, 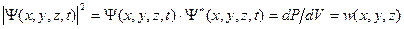 , где Ψ * означает комплексно сопряженную к Ψ величину, является плотностью вероятности.
, где Ψ * означает комплексно сопряженную к Ψ величину, является плотностью вероятности.
Волну де Бройля можно рассматривать как волну вероятности, амплитудой которой является волновая функция.
Де Бройль постулировал, что свободное движение частицы с определенной энергией E и импульсом 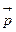 описывается волновой функцией вида:
описывается волновой функцией вида:
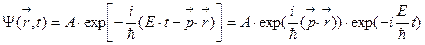 .
. 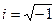 – мнимая единица.
– мнимая единица.
Функция Ψ должна удовлетворять т.н. стандартным условиям. Она должна быть однозначной, поскольку микрочастица в определенный момент времени может находиться только в одной точке пространства. Волновая функция и ее частные производные по координатам являются непрерывными во всех точках пространства (при движении частица не может исчезать в одном месте и появляться в другом). И наконец, волновая функция должна быть конечна, т.е. нигде не обращаться в бесконечность. Поскольку значение 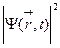 , вычисленное в некоторой точке, пропорционально вероятности Р обнаружения частицы, описываемой функцией Ψ, в этой точке, то интеграл от
, вычисленное в некоторой точке, пропорционально вероятности Р обнаружения частицы, описываемой функцией Ψ, в этой точке, то интеграл от 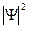 по всему пространству должен быть конечным, так как в любом случае частица где-то должна быть. Обычно этот интеграл приравнивают единице:
по всему пространству должен быть конечным, так как в любом случае частица где-то должна быть. Обычно этот интеграл приравнивают единице: 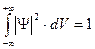 .
.
Волновую функцию, для которой выполняется это соотношение, называют нормированной, а само равенство – условием нормировки волновой функции.
Нахождение вида волновой функции частицы, движущейся под действием внешних сил, является основной задачей квантовой механики, так как задание волновой функции есть полное и исчерпывающее описание этой частицы. Это связано с тем, что вероятностное поведение микрочастиц лежит в самой их природе.
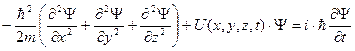 ,
,
где m – масса частицы, U(x,y,z,t) – потенциальная функция частицы в силовом поле.
Как и все основные уравнения физики (например, законы Ньютона, уравнения Максвелла), уравнение Шредингера не имеет вывода. Правильность уравнения Шредингера и толкование смысла фигурирующей в нем волновой функции подтверждаются огромным опытным материалом современной физики.
То, что уравнение Шредингера содержит лишь первую производную от Ψ по времени, связано с выражением принципа причинности: если известна волновая функция Ψ(x,y,z,0) частицы в начальный момент времени, то можно однозначно определить ее волновую функцию Ψ(x,y,z,t) в любые последующие моменты времени t > 0. Однако, точное знание ВФ для какой-либо точки пространства позволяет определить лишь вероятность обнаружения микрочастицы в этой точке.
Часто потенциальная функция U частицы явным образом не зависит от времени и в этом случае она имеет смысл потенциальной энергии. Силы, действующие на частицу, а следовательно, и U(х,у,z) зависят только от координат. В этих случаях уравнение Шредингера можно упростить, исключив всякую зависимость от t. Это получается, если ВФ представить в виде произведения координатной и временной частей:
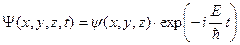 .
.
Подставив в зависящее от времени уравнение Шредингера это выражение и сократив все уравнение затем на общий экспоненциальный множитель, получим:
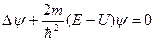 , где
, где 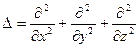 - т.н. оператор Лапласа.
- т.н. оператор Лапласа.
Это уравнение называется уравнением Шредингера для стационарных состояний.
Волновое уравнение Шредингера играет в квантовой механике ту же роль, что 2 закон Ньютона в классической механике. Задать закон движения частицы в квантовой механике – значит определить Ψ -функцию в каждый момент времени в каждой точке пространства.
Так как уравнение Шредингера является уравнением второго порядка в частных производных, то для его решения необходимо задавать начальные и граничные условия.
Квантовая частица в потенциальной яме. Рассмотрим одномерное (вдоль оси х) движение частицы в потенциальном поле, называющемся бесконечно глубокой прямоугольной потенциальной ямой шириной ℓ:
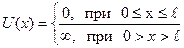 .
.
Так как энергия частицы Е не может быть бесконечной, частица не может находиться вне ямы, поэтому вероятность ее обнаружения вне ямы, а значит, и волновая функция, равна нулю: w (x <0)= w (x>ℓ) и ψ (x <0)= ψ (x>ℓ)=0.
Из условия непрерывности ВФ вытекает равенство нулю ВФ и на границе ямы: ψ(x=0)=ψ(x=ℓ)=0. Это граничные условия для решения уравнения Шредингера для частицы внутри потенциальной ямы: 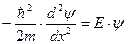 ,
,
где Е — полная энергия частицы.
Решение такого дифференциального уравнения имеет вид:
ψ=A·sin(k·x), где 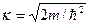 - волновое число.
- волновое число.
Используя граничное условие ψ(ℓ)=0, получим: κn ·ℓ=n·π,
где n =1,2,3,... – любое целое число, большее нуля (квантовое число). Еслиучесть, что импульс частицы pn = ħ·kn, то можнонайти возможные значения энергии частицы:
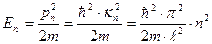 .
.
Уравнение Шредингера имеет решения, удовлетворяющие граничным условиям только при дискретных значениях квантового числа п. Энергия частицы в бесконечно глубокой потенциальной яме оказывается квантованной. Состояние частицы с наименьшей возможной энергией (n =1) называется основным, все остальные состояния – возбужденными. Волновая функция, отвечающая n -му уровню энергии: 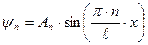 . Постоянную Аn определим из условия нормировки
. Постоянную Аn определим из условия нормировки 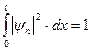 ;
; 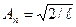 и
и 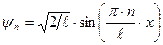 .
.
На границах ямы при х = 0 и х = ℓ всегда | ψn| 2 = 0, однако, вeроятность нахождения частицы в определенной точке внутри ящика может сильно меняться при разных значениях квантового числа п.
Выводы: энергия микрочастицы, движущейся в потенциальной яме, пробегает дискретный ряд значений; даже в основном состоянии частица не находится в состоянии полного покоя; дискретный характер энергетических уровней проявляется при малой массе частиц и малых размерах области, в которой происходит движение; при больших значениях квантовых чисел и пространственно неограниченном движении квантовомеханические соотношения переходят в формулы классической физики.
Квантовым гармоническим осциллятором называется микрочастица массы т, находящаяся в параболической потенциальной яме вида U(x)=κ·x2/2 и совершающая гармоническое движение с частотой ω; κ -постоянная.
Модель квантового осциллятора особенно полезна при исследовании малых колебаний систем около положения равновесия, например, колебаний атомов в узлах кристаллической решетки или колебаний атомов около их положений равновесия в молекуле.
По аналогии с классической теорией (пружинный маятник) положим 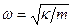 . Тогда для потенциальной энергии получим:
. Тогда для потенциальной энергии получим:
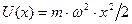 . Стационарное уравнение Шредингера в данном случае будет иметь вид:
. Стационарное уравнение Шредингера в данном случае будет иметь вид:
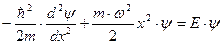 .
.
Полученное уравнение имеет конечные, однозначные и непрерывные решения, т.е. собственные функции, не для всех значений энергии Е, а только при собственных значениях, удовлетворяющих условию: 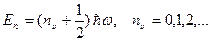
Число nυ называется колебательным квантовым числом. Из последнего равенства следует, что энергия квантового осциллятора квантуется. Энергетический спектр представляет собой эквидистантные, т.е. отстоящие друг от друга на одинаковую величину Δ E=ħω, уровни. Минимальная энергия, которой может обладать квантовый осциллятор, равна Е 0 = ħω / 2 и называется энергией нулевых колебаний, или нулевой энергией и соответствует абсолютному нулю температур.
То, что минимальная энергия осциллятора не может быть равна нулю даже при 0К, находится в соответствии с признанием относительности покоя и вечности движения. Если бы энергия частицы равнялась нулю, то это означало бы, что частица покоится и ее импульс и координата одновременно имеют точные значения, что противоречит принципу неопределенностей. Существование нулевых колебаний доказывают опыты по наблюдению рассеяния света прозрачными кристаллами при сверхнизких (вплоть до 10 – 6К) температурах.
Расчет показывает, что для квантового осциллятора возможны переходы только между соседними уровнями, т.е. с изменением квантового числа nυ на единицу:
Δ nυ = ±1.
Это условие называется правилом отбора, оно показывает, какие из всех мыслимых переходов реализуются в действительности.
При каждом из переходов излучается или поглощается фотон (или другая частица – фонон) с энергией ħω, где ω – его циклическая частота.
Оптические атомные спектры. Известно, что в излучении нагретых тел представлены все длины волн (сплошной спектр).
Если нагреть до достаточно высокой температуры атомарный газ, то в спектре его излучения (спектре испускания) появляются яркие светящиеся линии с определенными дискретными длинами волн. Такие спектры называются линейчатыми. Каждый химический элемент обладает собственным линейчатым спектром.
Простейшим является атом водорода: он состоит из протона и электрона. У водорода самый простой спектр. Дж. Бальмер при изучении видимой части спектра водорода обнаружил четыре спектральные линии с частотами 4,552; 6,173; 6,912 и 7,317 (в 1014 с-1) и показал, что частоты этих линий могут быть рассчитаны по формуле: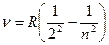 , где для первых четырех линий n принимает значения 3, 4, 5 и 6. R= 3,29·1015 c-1 - постоянная Ридберга, была определена экспериментально. Впоследствии были обнаружены линии, соответствующие другим значениям п> 6.
, где для первых четырех линий n принимает значения 3, 4, 5 и 6. R= 3,29·1015 c-1 - постоянная Ридберга, была определена экспериментально. Впоследствии были обнаружены линии, соответствующие другим значениям п> 6.
Установлено, что по мере увеличения частоты линии располагаются все ближе и ближе друг к другу и становятся все менее интенсивными. Вблизи линии с частотой 0,8242·1015 с-1 линии сгущаются настолько, что их трудно различить. Эта частота, соответствующая п=∞, называется границей серии, после нее уже не наблюдается отдельных линий, а имеется слабо выраженный сплошной спектр.
Совокупность спектральных линий, обнаруживающих в своей последовательности и в распределении интенсивности описанную выше закономерность, называется спектральной серией.
Наряду с серией Бальмера в спектре атома водорода был обнаружен ряд других серий, представляемых совершенно аналогичными формулами:
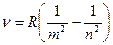 , m =1,2,3,… n=m+1,m+2,… Это т.н. обобщенная формула Бальмера.
, m =1,2,3,… n=m+1,m+2,… Это т.н. обобщенная формула Бальмера.
В ультрафиолетовой области Лайман открыл серию линий, частоты которых соответствуют значению m = 1.
В инфракрасной области были обнаружены другие спектральные серии (серии Пашена m = 3, Брэкета m =4, Пфунда m = 5 и т.д.).
Вид этих формул, дискретность частот, определяемую целыми числами n и m, не смогла объяснить классическая физика.
Боровская модель атома водорода. Спектральные серии и устойчивость атома водорода Н.Бор объяснил на основе двух постулатов:
|
|
Дата добавления: 2013-12-12; Просмотров: 739; Нарушение авторских прав?; Мы поможем в написании вашей работы!