
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Первый постулат:в атоме существуют такие орбиты, двигаясь по которым электроны энергии не излучают. Эти орбиты называются стационарными
|
|
|
|
Второй постулат: при переходеэлектронас одной стационарной орбиты на другуюиспускается или поглощается один фотон, энергия которого (в силу закона сохранения энергии) определяется соотношением: h·ν mn= E m – E n, где E m и En — энергии электрона в m -ом и n -ом стационарных состояниях.
Стационарными орбитами считаются такие, на которых момент импульса электрона равен целому кратному ħ (условие квантования Бора).
Момент импульса частицы массы т, движущейся по окружности радиусом r соскоростью υ, равен L = m·υ·r. Поэтому условие квантования Бора имеет вид: m·υ·rn = n·ħ, где n = 1,2,3,... Целое положительное число n называется квантовым числом орбиты, rn – радиус n -ой стационарной орбиты. Условие квантования можно получить, если считать, что на стационарной орбите укладывается целое число волн де Бройля, соответствующих электрону на этой орбите,: 2π· r n= n · λ Б.
Если считать орбиту электрона круговой, то уравнение движения электрона по 2 закону Ньютона: 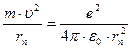 .
.
Решая это уравнение совместно с условием квантования находим для радиуса
n –стационарной орбиты: 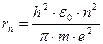 . Радиус ближайшей к ядру орбиты (т.н. первой боровской орбиты с п = 1) равен r1 =0,53·10 - 10м.
. Радиус ближайшей к ядру орбиты (т.н. первой боровской орбиты с п = 1) равен r1 =0,53·10 - 10м.
Полная энергия электрона в атоме водорода равна сумме его кинетической и потенциальной энергий: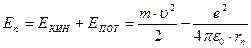 .
.
Решая это уравнение совместно с условиями квантования орбит и радиусов орбит находим для энергии стационарных состояний:  Из последнего соотношения видно, что так же, как и радиусы орбит, энергия электрона квантуется, т.е. принимает ряд дискретных значений. Ближайшая к ядру орбита (n =1) имеет самую низкую энергию (основное состояние):
Из последнего соотношения видно, что так же, как и радиусы орбит, энергия электрона квантуется, т.е. принимает ряд дискретных значений. Ближайшая к ядру орбита (n =1) имеет самую низкую энергию (основное состояние):
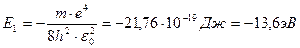 .
.
Энергия, равная 13,6 эВ, необходимая для удаления электрона из атома, называется энергией связи, или энергией ионизации Ei.
При переходе с m –ой орбиты на n –ую испускается фотон с частотой:
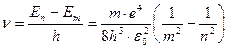 , что совпадает с формулой Бальмера.
, что совпадает с формулой Бальмера.
Множитель 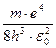 равен 3,29·1015 с-1, что совпадает с постоянной Ридберга.
равен 3,29·1015 с-1, что совпадает с постоянной Ридберга.
Несмотря на успехи, модель атома водорода Бора была непоследовательна, т.к. в ней, с одной стороны, постулируется квантование орбит, а с другой стороны, движение электрона по орбите рассматривается классически.
Атом водорода. Квантовомеханическое рассмотрение. Атом водорода представляет собой один электрон, находящийся в сферически симметричном поле положительно заряженного ядра. Потенциальная энергия взаимодействия электрона и ядра: 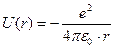 , т.е. можно считать, что электрон движется в гиперболической потенциальной яме. Уравнение Шредингера принимает вид:
, т.е. можно считать, что электрон движется в гиперболической потенциальной яме. Уравнение Шредингера принимает вид: 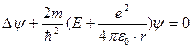 и его удобнее решать в сферической системе координат r, θ и φ. При этом решение ищется в виде произведения трех функций, каждая из которых зависит от одной переменной:
и его удобнее решать в сферической системе координат r, θ и φ. При этом решение ищется в виде произведения трех функций, каждая из которых зависит от одной переменной:
ψ (r,θ,φ) = R (r)· Y (θ)· Ф (φ).
В результате подстановки ψ (r,θ,φ) и разделения переменных уравнение разбивается на три независимых уравнения относительно r, θ и φ, соответственно. Учет физических условий приводит к возможным значениям R{r), Y (θ) и Ф (φ), а следовательно, и ψ -функции. При этом обнаруживается дискретность состояний.
Математически дискретность состояний заключается в том, что каждая из трех функций имеет дискретный набор значений, описываемых соответствующими квантовыми числами:
1) главное квантовое число п = 1,2,3....
Это число определяет уровни энергии En электрона в атоме водорода:  , что совпадает с выражением, полученным в модели атома Бора;
, что совпадает с выражением, полученным в модели атома Бора;
2) орбитальное квантовое число ℓ = 0,1,2,...(n – 1) – определяет геометрическую форму разрешенной для электрона области – орбиталь. Это число ℓ определяет значение орбитального момента импульса Lℓ электрона относительно ядра: 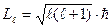 . При переходах из одного состояния в другое ℓ изменяется в соответствии с правилом отбора Δ ℓ = ±1. Правило отбора по квантовому числу ℓ обусловлено законом сохранения момента импульса.
. При переходах из одного состояния в другое ℓ изменяется в соответствии с правилом отбора Δ ℓ = ±1. Правило отбора по квантовому числу ℓ обусловлено законом сохранения момента импульса.
3) магнитное квантовое число mℓ = 0, ±1,±2,... ± ℓ, всего 2 ℓ + 1 значений. Это число определяет проекции орбитального момента импульса электрона на некоторое выделенное направление z: Lℓz =mℓ ·ħ. По другому, оно определяет ориентацию в пространстве орбитали. Правило отбора: Δ mℓ = 0,±1;
4)спиновое квантовое число mS, которое получается не из уравнения Шредингера, а из совокупности опытных данных. Это число может принимать только два значения (±½) и определяет возможные значения проекции LSZ на ось z собственного спинового момента импульса LS электрона: 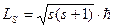 ; s = ½;
; s = ½;
LSz = mS ·ħ. Правило отбора для спинового квантового числа: Δ m S = 0.
Механическим моментам (орбитальному Lℓ и спиновому LS) соответствуют магнитные моменты, т.к. электрон – заряженная частица. Перечисленные четыре квантовых числа п, ℓ, mℓ и mS полностью описывают состояние электрона в атоме.
Спин. Расчет с помощью уравнения Шредингера энергетического спектра атома водорода показал незначительное расхождение теории с экспериментом. Высокоточные измерения обнаруживают т.н. тонкую структуру уровней энергии – их расщепление на ряд близких подуровней.
Полностью объяснить феномен тонкой структуры смогли лишь на основе такого фундаментального квантово-механического понятия, как спин элементарной частицы. К этому понятию привели результаты опытов О. Штерна и В. Герлаха, еще в 1922 г. наблюдавших расщепление (раздвоение) узкого пучка атомов серебра под действием неоднородного магнитного поля. Подобное поведение атомов можно объяснить, лишь предположив, что электрон, кроме орбитального, обладает собственным моментом импульса– спином и связанным с ним собственным магнитным моментом. Такое предположение было сделано в 1925 г. Дж. Уленбеком и С. Гаудсмитом.
Для квантово-механического описания микрочастицы необходимо задать проекцию спина на выбранную ось. Проекция спина может дискретно меняться на величину, кратную ћ. Число проекций равно в общем случае 2s + 1, где s– спиновое число частицы. Так, например, для электрона, имеющего спиновое число s=½ и спин  , проекция его спина на выбранную произвольную ось z
, проекция его спина на выбранную произвольную ось z 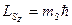 может принимать два значения (mS=±½):
может принимать два значения (mS=±½): 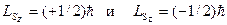 .
.
Значениями спина отличаются два фундаментальных класса элементарных частиц: фермионы имеют полуцелый спин, а бозоны – целочисленный спин. Спин, равный 1/2ћ, имеют электрон, протон, нейтрон, нейтрино, мюон и др. Спин фотона и глюона равен 1ћ, гравитона 2ћ. Спин элементарных частиц лежит в основе квантовой статистики и влияет на поведение систем, состоящих из тождественных частиц. Спин лежит в основе фундаментального принципа квантовой теории – принципа Паули, согласно которому две тождественные частицы с полуцелым спином (фермионы) не могут одновременно находиться в одном и том же квантовом состоянии. Благодаря этому принципу смогли объяснить образование электронных оболочек в атомах и связанную с этим закономерность периодической таблицы Менделеева; формирование ядерных оболочек и их строение; понять химическую связь молекул и многое другое. Со спином связывают появление таких необычных свойств, как сверхтекучесть гелия и сверхпроводимость у некоторых веществ.
Элементы квантовой статистики. Метод, позволяющий перейти от исследования движения отдельных частиц к поведению систем из огромного их числа, называется статистическим. При применении квантовой механики к системам одинаковых частиц были обнаружены свойства, не имеющие классических аналогов. Впервые это стало очевидным при построении теории электронных оболочек многоэлектронных атомов и при рассмотрении равновесного излучения как газа фотонов.
Условия применимости классической статистики – это условия, при которых в движении микрообъектов не проявляются квантовые эффекты. Классические частицы всегда можно различить по их состояниям: координатам и импульсам.
Три основных отличия квантовой статистики от классической:
1) квантовая механика – статистическая теория. Состояние квантовой системы определяется вероятностными законами распределения;
2) в квантовой механике многие физические величины могут принимать лишь дискретный ряд значений, в классической механике они непрерывны;
3) наиболее важное отличие классической и квантовой статистик связано с принципом тождественности, имеющим место только в квантовой механике. Поскольку в силу принципа неопределенностей понятие траектории частицы утрачивает смысл, то и различить частицы одинаковой природы невозможно, т.е. частицы становятся тождественными. Кроме того, системы частиц с целым (бозоны) и полуцелым (фермионы) спином подчиняются разным законам.
Бозоны описываются симметричными волновыми функциями (перестановка двух бозонов не изменяет ни одной из характеристик системы бозонов). К бозонам относятся частицы-переносчики взаимодействия, например, фотоны, глюоны, фононы, гравитоны. В каждом квантовом состоянии может находиться неограниченное количество бозонов. Их распределение по состояниям описывается т.н. статистикой Бозе–Эйнштейна.
Фермионы описываются антисимметричной волновой функцией (при перестановке двух фермионов волновая функция, описывающая систему фермионов, изменяет знак). К фермионам относятся частицы вещества, например, электроны, протоны, нейтроны, кварки и др. Они подчиняются принципу Паули: в каждом квантовом состоянии может находиться только одна частица. Их распределение по состояниям описывается статистикой Ферми–Дирака.
Различие статистик легко понять на следующем модельном примере: пусть нам надо распределить две частицы a и b по двум состояниям. Классические частицы можно распределить 4 способами; бозоны с учетом тождественности частиц – 3 способами; фермионы с учетом тождественности частиц и принципа Паули – 1 способом.
| Классические частицы a, b | Бозоны a≡b | Фермионы a≡b | ||||||||||||||||
|
|
|
В случае, когда дискретностью квантовых состояний можно пренебречь, например,
при высоких температурах, оба распределения перейдут в классическое распределение Больцмана.
Периодическая система элементов. По мере увеличения порядкового номера Z атома происходит последовательное заполнение электронных уровней атома в соответствии с принципом Паули: в атоме не может быть электронов с одинаковыми значениями всех четырех квантовых чисел п, ℓ, mℓ, mS. Поэтому каждый следующий электрон невозбужденного атома должен занимать самый глубокий из еще не заполненных уровней.
Каждому значению п соответствует 2п2 состояний, отличающихся друг от друга значениями квантовых чисел ℓ, mℓ, mS. Совокупность электронов атома с одинаковыми значениями квантового числа п образует оболочку. Оболочки обозначают большими буквами латинского алфавита:
п (Оболочка): 1(К), 2(L), 3(М), 4(N)…
Оболочки подразделяют на подоболочки, различающиеся орбитальным квантовым числом ℓ. Число состояний в подоболочке равно 2(2· ℓ +1). Подоболочки обозначают в виде 1 s; 2 s, 2 p; 3 s, З р, 3 d;...,,где цифра означает квантовое число п, т.е. принадлежность к соответствующей оболочке, а буква – орбитальное состояние или орбиталь согласно схеме:
ℓ (Орбиталь): 0(s), 1(p), 2(d), 3(f)…
Различные состояния в подоболочке отличаются значениями квантовых чисел mℓ и mS. Число возможных состояний в К, L, М, N,... оболочках равно соответственно 2, 8, 18, 32,..., т.е. 2 n 2.
Заполнение периодической системы элементов основано на идее об оболочечной структуре электронного облака атома. Каждый следующий атом получается из предыдущего добавлением к заряду ядра единицы и добавлением одного электрона, помещаемого в разрешенное принципом Паули состояние с наименьшей энергией.
Распределение электронов по состояниям называется электронной конфигурацией, например, для атома хлора (Z=17): 1s22s22p63s23p5.
Оболочка или подоболочка, полностью заполненная электронами, называется замкнутой и соответствует инертному газу. Наблюдаемая периодичность химических и физических свойств атомов объясняется поведением внешних валентных электронов.
Лазер. Между энергетическими уровнями атомов могут осуществляться следующие переходы: 1.Самопроизвольныепереходысуровней с большей энергией на уровни с меньшей энергией. В результате наблюдается спонтанное излучение – испускание атомами фотонов. 2. Происходящие под действием излучения вынужденные переходына более высокие энергетические уровни. В результате наблюдается поглощение излучения веществом.
3. Испускательные переходы, вызываемые действием на атомы, находящиеся в возбужденном состоянии, электромагнитной волны. Такой переход сопровождается вынужденным (индуцированным) излучением.
С волновой точки зрения, вынужденное излучение строго когерентно с вынуждающим излучением.
С квантовой точки зрения, процесс вынужденного излучения приводит к появлению вместо одного фотона с энергией ћω двух таких же фотонов. Новый фотон, появившийся в результате индуцированного излучения, усиливает свет.
Для работы усилителя света (лазера) необходимо создать инверсную населенность в рабочем теле, когда число атомов в возбужденном состоянии превышает их число в состоянии с меньшей энергией. При прохождении светом такой среды происходит его усиление.
Для получения большой интенсивности света в лазере используется т.н. положительная обратная связь, реализованная в виде оптического резонатора, представляющего собой два строго параллельных зеркала, между которыми располагается рабочее тело. Одно из зеркал – непрозрачное, а второе – полупрозрачно. Слабое вынужденное излучение, вышедшее из рабочего тела, циркулирует между двумя зеркалами, каждый раз обогащаясь новыми фотонами, до тех пор, пока его интенсивность не достигнет некоторого порогового значения, при котором светвыходит сквозь полупрозрачное зеркало. Необходимо еще, чтобы световая волна, идущая в одном направлении, при интерференции со встречной волной усиливалась. Это будет только в том случае, если между зеркалами возникнет стоячая волна, а именно, на расстоянии между зеркалами L должно укладываться целое число полуволн: L= k (λ/2). k – целое число. Лазер обязательно содержит систему накачки, создающую и поддерживающую инверсную населенность в рабочем теле лазера; она может быть оптическая, электрическая, химическая, ядерная и т.д. По рабочему телу лазеры подразделяются на твердотельные (кристаллы, стекла, полупроводники), жидкостные (растворы красителей в спирте), газовые. Длина волны определяется рабочим веществом. Лазерное излучение имеет хорошую когерентность, малую расходимость луча, монохроматично. Кроме того, если лазер импульсный, то могут быть достигнуты огромные интенсивности света.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 1644; Нарушение авторских прав?; Мы поможем в написании вашей работы!