
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Атомные орбитали
|
|
|
|
Магнитное квантовое число
Магнитное квантовое число ml характеризует пространственную ориентацию электронного облака. Магнитное квантовое число ml = - l ¸ l.
При l = 0; m l = 0, т.е. у s-электронного облака отсутствует ориентация (рис.1.1).
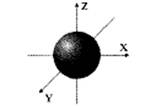
Рис.1.1.
При l = l, ml = -1, 0, 1. Три значения ml соответствуют трем ориентацием р-электронных облаков в пространстве по направлениям координатных осей X, Y, Z:: рx, ру, рz (рис.1.2).
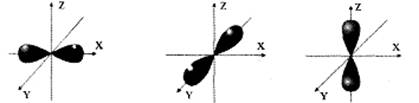
Рис.1.2
При l = 2; m l = - 2, -1, 0, 1, 2. Этим пяти значениям m l соответствует пять пространственных положений d-электронных облаков, причем три d-орбитали имеют диагональное расположение между осями X, Y, Z (dxy, dxz dyz;); две остальные d-орбитали направлены вдоль осей координат (dx2y2, dz2) (рис.1.3).
При l = 3; m l = -3, -2, -1, 0, 1, 2, 3. Этим семи значениям ml ответствуют семь пространственных положений f –электронных облаков.
Совокупность положений электрона в атоме, характеризуемых тремя квантовыми числами п, l, ml, называется атомной орбиталью. Вероятность нахождения электрона в пространстве вокруг ядра атома составляет более 95%. Атомные орбитали называются квантовыми ячейками и схематически изображаются в виде клетки (энергетической ячейки). Количество орбиталей на подуровне можно вычислить
N(ml) = 2 l + 1





 s - подуровень
s - подуровень




 p - подуровень
p - подуровень






 d - подуровень
d - подуровень
f - подуровень
На s-подуровне содержится только одна атомная орбиталь, на р-подуровне - 3, на d-подуровне - 5, а на f -подуровне - 7.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 456; Нарушение авторских прав?; Мы поможем в написании вашей работы!