
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энергия и длина связи
|
|
|
|
Валентность
Валентность - это способность атома к образованию химической связи.
Количественной мерой валентности атома принято считать число связей, которые образует он в молекуле.
Согласно обменному механизму метода валентных схем валентность атома элемента определяется числом содержащихся в атоме неспаренных электронов.
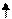
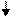


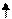



 N: 2s2 2р3
N: 2s2 2р3
Валентность азота в основном состоянии равна трем.
Спаренные электроны при возбуждении атома могут разъединяться при наличии свободных орбиталей на том же энергетическом уровне.
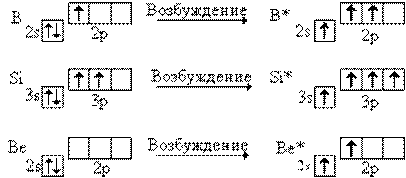
Атомы фтора и кислорода не имеют свободных орбиталей во внешнем электронном уровне, поэтому валентность F равна 1,а О – 2. Сера и хлор проявляют переменную валентность из-за наличия d- орбитали.
Характеристиками химической связи является энергия и длина связи.
Энергией химической связи называют то количество энергии, которое выделяется при образовании химической связи. Эта величина является характеристикой прочности связи; ее выражают в кДж на 1 моль образовавшегося вещества (Энергия химической связи в молекуле HCl = 431,8 кДж/моль)
Чем больше энергия связи, тем прочнее связь. Энергию химической связи оценивают, сравнивая с состоянием, предшествующим образованию химической связи (для двухатомных молекул). Для трех- и многоатомных молекул с одинаковым типом связи рассчитывают среднюю энергию связи.
Средняя энергия связи в молекуле определяется делением энергии образования молекулы на число связей (NH3 = 1170 кДж/моль; EN-H = 390 кДж/моль).
Длиной химической связи называют расстояние между ядрами атомов в молекуле.
Длина связи обусловлена размерами реагирующих атомов и степенью перекрывания их электронных облаков. С увеличением Z длина связи атома с
у более электроотрицательного атома. Если электронная пара, образующая химическую связь, смещается к одному из ядер атомов, то такая связь называется полярной ковалентной связью.
Вследствие того, что электронная пара смешается от одного атома к другому, атомы приобретают эффективный заряд.
Количественной мерой полярности связи является электрический момент диполя связи.
Электрический момент диполя связи mсв численно равен произведению эффективного заряда d на расстояние между центрами атомов водорода увеличивается, а энергия связи уменьшается.
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 1350; Нарушение авторских прав?; Мы поможем в написании вашей работы!