
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ионная связь
|
|
|
|
Ковалентная связь и ее свойства
Ковалентная связь - химическая связь между атомами, осуществляемая обобществленными электронами, и являющаяся универсальным типом химической связи.
Идея об образовании химической связи с помощью пары электронов, принадлежащих обоим соединяющимся атомам, была высказана в 1916г. американским ученым Дж. Льюисом.
Ковалентная связь может возникать как между одинаковыми атомами (в молекулах Н2, Сl2, в кристалле алмаза С), так и между различными (в молекулах НС1, Н2S).
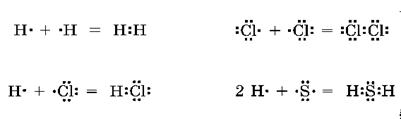
Основными свойствами ковалентной связи являются ее насыщаемость и направленность.
Насыщаемость ковалентной связи обусловлена тем, что в химическом взаимодействии участвуют электроны только внешних уровней, т. е. ограниченное количество электронов.
Ковалентная связь обладает свойством направленности, т.к. электронные облака атомов имеют определенную направленность, а значит и область перекрывания электронных облаков находится в определенном направлении по отношению к взаимодействующим атомам.
Ковалентная связь называется неполярной, если одна или несколько общих электронных пар в равной мере принадлежат обоим атомам, т. е. смещения электронных пар не происходит.
Если два взаимодействующих атома имеют различную электроотрицательность, то электронная пара смещается к ядру тяжести положительного и отрицательного зарядов в молекуле l:
mсв = d l.
Чем больше разность электроотрицательностей связанных атомов, тем больше длина связи и больше полярность связи.
Связь называется ионной, если она осуществляется путем электростатического взаимодействия разноименно заряженных ионов, образовавшихся при смещении электронов от одного атома к другому.
Ее можно рассматривать как предельный случай ковалентной полярной связи. Ионная связь может возникать только в том случае, если различия в электроотрицательности взаимодействующих атомов достаточно велики.
Если разность относительных электроотрицательностей взаимодействующих атомов DХ равна 0, то образуется ковалентная неполярная связь; если 0< DХ <1,7 - ковалентная полярная; если DХ > 1,7 - ионная. Ионная связь возникает, когда один из атомов металл (Na+CI-, K+OH-, Na+H-).
Поскольку электростатическое поле иона имеет сферическую симметрию, то ионная связь не обладает направленностью.
Взаимодействие двух заряженных ионов не приводит к полной компенсации их полей, поэтому ионная связь не обладает насыщаемостью.
Для ионной связи эффективные заряды атомов»1. Химическая связь не может быть на 100% ионной. Долю ионного характера связи называют степенью ионности, которая количественно характеризуется эффективными зарядами атомов в молекуле.
Таким образом, природа химической связи едина, и существующее различие между видами связи имеет количественный характер.
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 319; Нарушение авторских прав?; Мы поможем в написании вашей работы!