
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Второе начало термодинамики. Энтропия
|
|
|
|
Второе начало термодинамики. Энтропия
 Рассмотрим теплообмен между двумя системами, которые отличаются температурой (Т1 > Т2).
Рассмотрим теплообмен между двумя системами, которые отличаются температурой (Т1 > Т2).
Из выражения первого начала термодинамики DU = Q - Аследует, что изменению внутренней энергии DU может соответствовать множество процессов с передачей различных количеств теплоты и работы, лишь бы их алгебраическая сумма оставалась равной величине DU.
Однако некоторые процессы, для которых соблюдается первое начало термодинамики, неосуществимы на практике. Со стороны первого начала термодинамики нет никаких препятствий к тому, чтобы при теплообмене двух тел тепло переходило от менее нагретого к более нагретому телу самопроизвольно. Однако из опыта известно, что такие процессы не реализуются.
Запрещая вечный двигатель 1-го рода, первое начало термодинамики не исключает возможности создания такой машины непрерывного действия, которая бы была способна превращать в полезную работу всю подводимую к ней теплоту (так называемый вечный двигатель 2-го рода). В тоже время экспериментально установлено, что если работа может быть полностью превращена в теплоту, то только часть теплоты может быть обращена в работу. (Здесь речь не идет о термодинамическом цикле, для которого выполняется принцип эквивалентности теплоты и работы). Другая часть рассеивается в окружающую среду. Природа признает эквивалентность теплоты и работы, но требует «дань», когда теплота превращается в работу.
Какие процессы возможны, а какие нет, устанавливает второе начало термодинамики.
1. Невозможен процесс, при котором теплота переходила бы самопроизвольно от тел более холодных к телам более нагретым. Формулировка Р. Клаузиуса (1850).
2. Невозможно теплоту какого-либо тела превратить в работу, не производя никакого другого действия, кроме охлаждения этого тела. Формулировка У. Томсона (1851).
3. Для любого реального процесса невозможно найти способ возвращения системы в её первоначальное состояние, т. е. любой реальный процесс в термодинамике считается необратимым.
Тепловой эффект реакции не определяет направления процесса, т.к. самопроизвольно могут протекать как экзотермические так и эндотермические реакции.
Для количественной оценки степени необратимости реальных процессов Р. Клаузиусом в 1865г. было введено представление о новом термодинамическом параметре, получившем название энтропии (от греч. поворот или превращение).
Энтропия - величина, бесконечно малое приращение которой при изотермическом сообщении системе элементарного количества теплоты определяется как
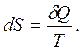 (2.30)
(2.30)
Энтропия – это количество рассеянной теплоты, отнесенная к 1-му Кельвину. Энтропия является функцией состояния, т.е. её изменение не зависит от пути процесса, а определяется только начальным и конечным состояниями системы:
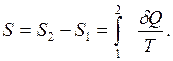 (2.31)
(2.31)
Энтропия обладает свойством аддитивности, т.е. изменение энтропии всей системы в целом складывается из изменения энтропии отдельных её частей: изменение энтропии в сложном процессе представляется как сумма изменений энтропии на отдельных её стадиях.
Изменение энтропии химической реакции равен разности сумм энтропий продуктов реакции и исходных веществ с учетом стехиометричесих коэффициентов.
DS = Σ nпр Sпр - Σ nисх Sисх (2.32)
Такие изотермические процессы, как плавление, испарение, возгонка протекают с поглощением тепла. Изменение энтропии таких реакций можно вычислить по уравнению
ΔS = ΔН/Т (2.33)
Энтропия - это мера беспорядка, которую Больцман описал уравнением
S = к lg W (уравнение Больцмана), (2.34)
где к–постоянная Больцмана; W- термодинамическая вероятность состояния или мера неупорядоченности системы.
При переходе из кристаллического состояния в газообразное неупорядоченность возрастает. Беспорядочное состояние более вероятно.
Wк < Wж < Wг
Sк < Sж < Sг
S0(Н2О) 39 70 189 Дж/моль К
Рост энтропии является признаком естественных процессов, которые характеризуются снижением качества энергии или ее деградации. Она является мерой непревращенности тепла в работу.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 475; Нарушение авторских прав?; Мы поможем в написании вашей работы!