
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Свободная энергия Гельмгольца. Свободная энергия Гиббса
|
|
|
|
Второе начало термодинамики для обратимых и необратимых процессов. Объединенное уравнение первого и второго начал термодинамики
Для обратимых процессов справедливо выражение
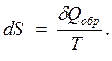 (2.35)
(2.35)
Уравнение представляет собой математическую формулировку второго начала термодинамики для обратимых процессов.
В изолированных системах:
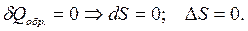 (2.36)
(2.36)
Если процесс совершается при конечном изменении состояния системы, то
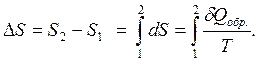 (2.37)
(2.37)
Полное приращение энтропии в обратимом круговом процессе равно нулю
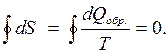 - равенство Клаузиуса (2.38)
- равенство Клаузиуса (2.38)
Для обратимых процессов второе начало термодинамики представляет собой закон о существовании и сохранении энтропии. При обратимых процессах в изолированной системе энтропия остается постоянной.
Если обратимые процессы происходят в неизолированной системе, то энтропия системы может изменяться с изменением энтропии окружающей среды, причем таким образом, чтобы сумма энтропии оставалась постоянной.
Иногда энтропию называют мерой беспорядка: чем меньше упорядочено вещество, тем выше его энтропия. Энтропия возрастает с увеличением температуры.
Следствием из второго начала термодинамики является то, что работа любого необратимого процесса всегда меньше работы обратимого процесса между одними и теми же начальным и конечным состояниями,т.е.
Анеобр < Аобр,
δАнеобр < Аобр (2.39)
Поэтому работа в обратимом процессе называется максимальной работой; чем меньше работа по сравнению с максимальной, тем более необратим процесс. Процессы, происходящие без совершения работы, являются полностью необратимыми.
Энтропияявляется критерием равновесия и самопроизвольности только тех процессов, которые идут в изолированных системах, т.е. (U,V=const). Химические процессы обычно протекают либо при постоянном объеме и температуре (закрытые системы), либо при постоянном давлении и температуре (открытые системы).
В изобарно-изотермических условиях движущей силой процесса является стремление системы уменьшить энергию, т.е. выделить тепло в окружающую среду.
ΔН<0 или рост S - DS>0– критерий самопроизвольности.
Если ΔН=0, то рост энтропии является единственной движущей силой и наоборот при DS=0 – движущей силой является убыль Н.
Требования U,V=const исключает использование S как критерия направления и протекания процессов при которых U и V меняются. Но с помощью энтропии можно вычислить другие термодинамические функции, которые являются более подходящими критериями оценки состояний системы.
Поэтому в качестве критерия направления и протекания процессов введены термодинамические функции включающие энтропию.
F = U – TS;
G = H – TS. (2.48)
Функции F и G называются соответственно свободной энергией Гельмгольца (изохорно-изотермический потенциал) и свободной энергией Гиббса (изобарно-изотермический потенциал). TS характеризует связанную энергию, которая не может быть превращена в работу в изотермическом процессе, а лишь переходит в тепло.
F и G являются функциями состояния, так как выражаются через функции состояния. Эти функции используются как критерии равновесия и направления процесса в системе:
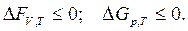 (2.49)
(2.49)
Из выражений следует, что ΔF и ΔG остаются постоянными для обратимых процессов и уменьшаются для необратимых. Обратимые процессы протекают т.о., что при возврате системы в исходное состояние никаких изменений в окружающей среде не происходит. При необратимых процессах систему нельзя вернуть в исходное состояние.
Равновесное состояние системы описывается выражением
ΔFV,Т = 0, ΔGр,T = 0. (2.50)
В состоянии равновесия при постоянном объеме и температуре энергия Гельмгольца, а при постоянном давлении и температуре энергия Гиббса минимальны.
Изменение трех критериев равновесия и направления процесса в системе, а именно S, F и G, можно изобразить следующим образом (рис.2.3):


 U,V=const V,T=const р,Т=const
U,V=const V,T=const р,Т=const



 S В F A G A
S В F A G A
А B B
 Ход процесса
Ход процесса
Рис. 2.3.
т. В – состояние равновесия, сплошной участок – самопроизвольный процесс.
В состоянии равновесия энтропия максимальна, а свободные энергии Гельмгольца и Гиббса имеют минимум.
Т.о. при р,Т=const реакция протекает самопроизвольно в направлении уменьшения D G, а при V,T=const в в направлении уменьшения D F.
Изменение этих функций для химических процессов вычисляется по формулам
D F = DU – TDS; DG = DH - TDS. (2.51)
Рассмотрим изменение DG при изменении DH и DS
DH DS DG
<0 >0 <0 протекает самопроизвольно при любых Т;
<0 <0 <0 протекает самопроизвольно низких Т;
>0 >0 <0 протекает самопроизвольно высоких Т;
>0 <0 >0 протекает самопроизвольно обратный процесс.
Чем < DG, тем дальше система от состояния равновесия и тем более реакционноспособна. При равновесии DG=0 и DН= ТDS.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 1701; Нарушение авторских прав?; Мы поможем в написании вашей работы!