
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Это метод уборки ртути (иногда используют KMnO4). Пары ртути очень ядовиты!
|
|
|
|
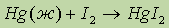
При нагревании все элементы II В группы взаимодействуют с кислородом, серой и галогенами, проявляя в этих соединениях характерную степень окисления +2. (Оксид ртути (II) HgO – разлагается на ртуть и кислород (см. выше)).
С водой в нормальных условиях ртуть не взаимодействует, равно как цинк и кадмий, которые пассивируются вследствие наличия на поверхности оксидной пленки.
Ртуть не взаимодействует с кислотами неокислителями, а кадмий и цинк образуют с ними соли (II) и вытесняют водород.
По-разному, в зависимости от условий, реагируют эти элементы и с кислотами окислителями. Так:
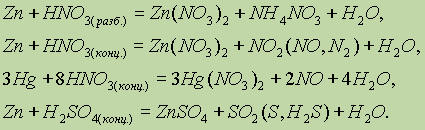
Цинк и его соединения. Цинк в соединениях проявляет только одну степень окисления 2+. В лабораториях его часто используют для получения водорода из разбавленной соляной кислоты:
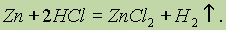
Цинк взаимодействует с раствором аммиака, вытесняя из него водород:
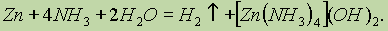
Оксид цинка. Оксид цинка ZnO проявляет амфотерные свойства, реагируя как с кислотами:
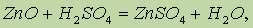
так и с щелочами:

В последней реакции образуется анионный комплекс тетрагидроксицинката.
Гидроксид цинка. Гидроксид цинка также проявляет амфотерные свойства.Он нерастворим в воде, но растворяется в кислотах и щелочах:
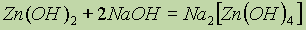

При взаимодействии гидроксида цинка с раствором аммиака образуется гидроксид тетраамминцинка (как и в реакции чистого цинка с р-ром NH3).
Иначе ведет себя в этой реакции Hg2+(гидроксид ртути (II) мгновенно разлагается на HgO и H2O):
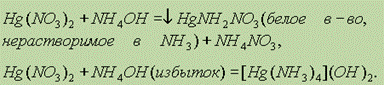
Соли цинка и ртути. Сульфид цинка в взаимодействует с соляной кислотой:
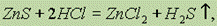
тогда как сульфид ртути растворяется только в “царской водке”:
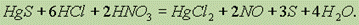
При взаимодействии сульфида ртути с сульфидом калия образуется комплексное соединения хорошо растворимое в воде:
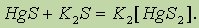
Пожалуй, самое известное соединение ртути – Hg(SCN)2 – цианат, используемое для заполнения капсул детонаторов, разлагающееся с эффектным образованием “фараоновых змей”:
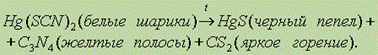
Еще одно известное соединение ртути – HgCl2 – сильный яд! Хотя в медицине и применяется как анитсептик. При взаимодействии сулемы с аммиаком образуется аминосоединение, которое используется в медицине для приготовления мазей:

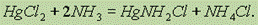
При взаимодействии сулемы с ртутью образуется еще одно ядовитое соединение ртути – каломель Hg2Cl2:
 .
.
В этом соединении присутствуют связи ¾ Hg ¾ Hg ¾.
Каломель выделяется и при разложении аминосоединения ртути, образующегося по вышеприведенной реакции:
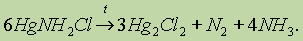
При взаимодействии каломели с хлором образуется хлорид ртути (II), а в реакции в хлоридом олова (II), выделяется ртуть:
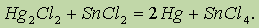
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 426; Нарушение авторских прав?; Мы поможем в написании вашей работы!