
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общие представления о химическом равновесии. Константа химического равновесия
|
|
|
|
Химические реакции, в результате которых хотя бы одно из исходных веществ расходуется полностью, называются необратимыми, протекающими до конца.
Однако большинство реакций являются обратимыми, т.е. идущими в двух противоположных направлениях (прямом и обратном). Особенность таких реакций: они не протекают до конца, в системе всегда остается каждое из исходных веществ. Примеры:
2NO + Cl2 Û 2NOCl;
H2 + I2 Û 2HI;
N2 + 3H2 Û 2NH3;
СО + H2O Û CO2 + H2 и т.д.
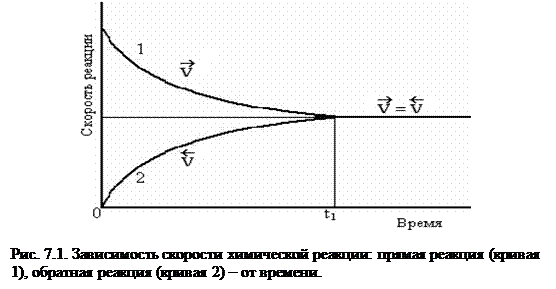 |
Все обратимые реакции идут до состояния равновесия. Реакция, протекающая в правую сторону (→) – прямая реакция, а в левую сторону (¬) – обратная реакция. Кинетические кривые для прямой (1) и обратной (2) реакции представлены на рис. 7.1.
Со временем скорость прямой реакции, V®, уменьшается, а скорость обратной, V¬, возрастает. В некоторый момент времени V® становится равной V¬, наступает химическое равновесие (частный случай термодинамического равновесия).
Химическим равновесием называют такое состояние реагирующей системы, при котором скорость прямой реакции V® равна скорости обратной реакции V¬. Равенство V® = V¬ является кинетическим условием химического равновесия.
Химическое равновесие характеризуется постоянством величины энергии Гиббса системы GP,T. Равенство D GP,T = 0 является термодинамическим условием химического равновесия.
Концентрации исходных веществ и продуктов реакции (реагирующих веществ), которые устанавливаются при химическом равновесии, называют равновесными. Обычно их обозначают при помощи квадратных скобок, например, [NO], [Cl2], [NOCl], в отличие от неравновесных концентраций, СNO, ССl2, СNOCl.
Химическое равновесие является динамическим или подвижным. Это означает, что в системе, находящейся в состоянии химического равновесия, с равной скоростью идут прямой и обратный процессы, поэтому в системе видимых изменений не наблюдается, т.е. макроскопические параметры, в том числе концентрации веществ, остаются постоянными.
Допустим, что в гомогенной системе протекает обратимая химическая реакция:
аА + bВ Û сС +dD. (1)
В соответствии с законом действия масс:
V® = k® · [А]a · [В]b, (2)
V¬ = k¬ · [С]c · [D]d. (3)
В состоянии химического равновесия V® = V¬ или
k® · [А]a · [В]b = k¬ · [С]c · [D]d. (4)
После преобразования:
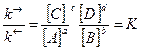 , (5)
, (5)
где К – константа равновесия химической реакции.
Закон действия масс для обратимых химических процессов формулируется следующим образом: отношение произведения молярных концентраций продуктов реакции к произведению молярных концентраций исходных веществ, взятых в степени их стехиометрических коэффициентов, при данной температуре равно постоянной величине, называемой константой химического равновесия.
Константа равновесия, как следует из выражения (5), равна отношению констант скоростей прямой и обратной реакций. Она показывает, во сколько раз скорость прямой реакции больше скорости обратной реакции, если концентрации каждого из реагирующих веществ равны 1 моль/л. В этом заключается физический смысл константы химического равновесия K.
Константа равновесия зависит от температуры протекания процесса (поскольку k® и k¬ зависят от температуры) и природы реагирующих веществ, но не зависит от их концентрации и наличия катализатора.
Например, для гомогенной химической реакции синтеза и разложения йодоводорода:
I2(г) + Н2(г) Û 2HI(г),
выражение для константы химического равновесия будет иметь вид
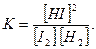
Если в гетерогенной системе протекает обратимая химическая реакция, то к ней также применим закон действующих масс, но в выражение для константы химического равновесия не входят концентрации реагирующих веществ, находящихся в конденсированном состоянии (твердом или жидком), т.к. их концентрации остаются, как правило, постоянными и входят в значение соответствующих констант скоростей химической реакции. Например, для гетерогенной реакции (термического разложения) карбоната кальция:
CaCO3(тв) Û СaO(тв) + CO2(г),
выражение для константы химического равновесия будет иметь вид К = [СО2].
Константа химического равновесия связана с изменением энергии Гиббса химической реакции (изобарно-изотермическим потенциалом) ΔG уравнением
ΔG = - RT lnK или К = ехр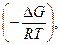 (6)
(6)
где R – универсальная газовая постоянная (8,31 Дж/(моль∙К)); Т – абсолютная температура, К; К – константа равновесия.
При стандартных условиях (Т = 298 К): ΔG0298 (кДж) = - 5,71 · lgK298.
Приведенное уравнение позволяет по величине ΔG вычислить К, а затем и равновесные концентрации (парциальные давления) реагентов. Если:
· K > 1, то ΔG < 0, в равновесной смеси преобладают продукты взаимодействия, равновесие смещено вправо (протекает прямая реакция);
· K < 1, то ΔG > 0, в равновесной смеси преобладают исходные вещества, равновесие смещено влево (обратная реакция);
· K = 1, то ΔG = 0, скорости прямой и обратной реакций равны между собой, состояние химического равновесия.
|
|
|
|
|
Дата добавления: 2013-12-11; Просмотров: 342; Нарушение авторских прав?; Мы поможем в написании вашей работы!