
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Фазовые равновесия. Правило фаз Гиббса
|
|
|
|
Гетерогенные равновесия, связанные с переходом вещества из одной фазы в другую без изменения химического состава, называются фазовыми.
К ним относятся равновесия в процессах испарения, плавления, конденсации и т.п. Фазовые равновесия, как и химические, характеризуются минимальным значением энергии Гиббса системы (DG0Т = 0) и равенством скоростей прямого и обратного процессов. Так, равновесие в системе «вода – лед» Н2О(ж.) Û Н2О (кр.) характеризуется равенством скоростей процессов плавления льда и кристаллизации воды.
Равновесие в гетерогенных системах зависит от давления, температуры и концентрации компонентов в системе. Для фазового равновесия, так же как и для химического равновесия, справедлив принцип Ле Шателье.
Прежде чем сформулировать правило фаз Гиббса, определим некоторые понятия.
Фаза (Ф) – часть термодинамической системы, однородная во всех точках по составу и свойствам и отделенная от других частей системы поверхностью раздела.
Компонент (К) или составная часть системы – вещество, которое может быть выделено из системы и существовать вне ее.
Наименьшее число компонентов, через которое выражается состав любой фазы, называется числом независимых компонентов данной системы. При рассмотрении фазовых равновесий, когда в системе не происходит химических превращений, понятия «компонент» и «независимый компонент» совпадают.
Число степеней свободы (С) или вариантность системы – число условий (температура, давление, концентрация), которые можно менять произвольно, не изменяя числа и вида фаз системы.
Соотношение между числом фаз (Ф), компонентов (К) и степеней свободы (С) в гетерогенной равновесной системе определяется правилом фаз Гиббса:
С = К – Ф + n, (7)
где n – число внешних факторов, влияющих на равновесие в системе.
Таковыми, как правило, являются температура и давление. Тогда n = 2 и уравнение (7) принимает вид:
С = К – Ф + 2. (8)
По числу степеней свободы системы делятся на инвариантные (С = 0), моновариантные (С = 1), бивариантные (С = 2) и поливариантные (С > 2).
При изучении фазовых равновесий широко используется графический метод – метод построения диаграмм состояния. Диаграмма состояния для любого вещества строится на основании опытных данных. Она позволяет судить: 1) об устойчивости какой-либо одной фазы системы; 2) об устойчивости равновесия между двумя или тремя фазами при заданных условиях. Для примера рассмотрим диаграмму состояния однокомпонентной системы (К = 1) – воды (рис. 7.2).
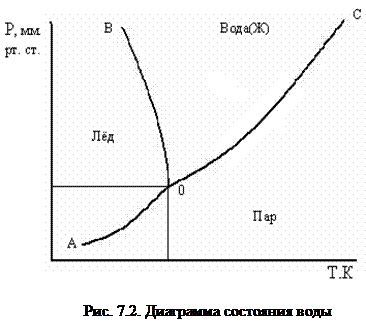 Три кривые АО, ОВ, и ОС, пересекающиеся в одной точке О, делят диаграмму на три части (по́ля, области), каждая из которых отвечает одному из агрегатных состояний воды – пару, жидкости или льду. Кривые отвечают равновесию между соответствующими фазами. Кривая АО выражает зависимость давления насыщенного пара надо льдом от температуры и называется кривой возгонки (сублимации). Для кривой АО: К= 1, Ф= 2, n = 2, тогда число степеней свободы, С = 1 – 2 + 2 = 1. Это значит, что произвольно можно менять только температуру (или только давление) – система моновариантна.
Три кривые АО, ОВ, и ОС, пересекающиеся в одной точке О, делят диаграмму на три части (по́ля, области), каждая из которых отвечает одному из агрегатных состояний воды – пару, жидкости или льду. Кривые отвечают равновесию между соответствующими фазами. Кривая АО выражает зависимость давления насыщенного пара надо льдом от температуры и называется кривой возгонки (сублимации). Для кривой АО: К= 1, Ф= 2, n = 2, тогда число степеней свободы, С = 1 – 2 + 2 = 1. Это значит, что произвольно можно менять только температуру (или только давление) – система моновариантна.
Кривая ОС выражает зависимость давления насыщенного пара над жидкой водой от температуры и называется кривой испарения или конденсации. Для кривой ОС: К= 1, Ф= 2, n = 2, тогда число степеней свободы С = 1–2 + 2 = 1, т.е. система моновариантна.
Кривая ОВ выражает зависимость температуры плавления льда (или замерзания жидкой воды) от давления и называется кривой плавления или кристаллизации. Для кривой ОВ: К= 1, Ф= 2, n= 2, тогда число степеней свободы С = 1 – 2 + 2 = 1, т.е. система моновариантна.
Все рассмотренные кривые (АО, ОВ, ОС) соответствуют переходу воды из одного фазового состояния в другое, т.е. определяют равновесие двух фаз. Области, ограниченные этими кривыми, отвечают условиям существования одной фазы. Для каждой из этих областей: К = 1, Ф = 1, n = 2, тогда число степеней свободы С = 1 – 2 + 2 = 2 – система бивариантна, т.е. в известных пределах можно менять значения р и Т независимо друг от друга, не изменяя числа фаз.
Все кривые пересекаются в точке О – тройная точка – она соответствует равновесию всех трех фаз:
Лед Û Жидкая вода Û Пар.
Для тройной точки: К = 1, Ф = 3, n = 2, тогда число степеней свободы С = 1 – 3 + 2 = 0 – система инвариантна, т.е. условия равновесия (температура и давление) строго определены и ни одно из них не может изменяться: Т = 273,1 К, Р = 610 Па (4,58 мм рт.ст.).
[1] Если закон Авогадро применим только для газов, то число Авогадро имеет универсальный характер для любого агрегатного состояния вещества.
[2] Все рассмотренные газовые законы строго соблюдаются при очень малых давлениях, при обычных невысоких давлениях они соблюдаются приближенно, а при высоких давлениях наблюдаются большие отклонения от этих законов.
1 Представление об электронных семействах элементов и их валентных электронах см. в разделе 2.8.
1 Валентные электроны атома – это электроны, способные участвовать в образовании химических связей в молекулах, ионах и т.д.
1 Приведены эффективные радиусы, экспериментально найденные для металлического состояния простых веществ.
2 В этом случае f-сжатие называется лантаноидным.
1 В скобках указано число электронов на внешнем энергетическом уровне иона.
[3] Реакция протекает в расплаве веществ.
1 Реакция протекает в расплаве веществ.
2 Реакция протекает в расплаве веществ.
3 Реакция протекает в растворе.
|
|
|
|
|
Дата добавления: 2013-12-11; Просмотров: 938; Нарушение авторских прав?; Мы поможем в написании вашей работы!