
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ковалентные s-связи между s- орбиталями
|
|
|
|
КВАНТОВО-ХИМИЧЕСКОЕ ОБЪЯСНЕНИЕ КОВАЛЕНТНОК СВЯЗИ
Квантово-механические представления о строении электронных оболочек атомов позволяют качественно объяснить и количественно рассчитать в соответствии с современным уровнем развития квантовой химии образование ковалентной связи.
Если друг к другу приближаются два атома, каждый из которых имеет занятую одним электроном орбиталь, то между атомами возникает ковалентная связь. Простейший пример образования ковалентной связи представляет собой объединение двух атомов водорода в молекулу Н2 (рис. 1) СЛ. 4.

Рис. 1.Образование ковалентной связи при перекрывании атомных орбиталей водорода.
По методу валентных связей при сближении двух атомов водорода происходит перекрываниеих s-орбиталей, каждая из которых содержит один электрон. Этот процесс сопровождается выделением энергии при образовании общей электронной пары. Поскольку между положительно заряженными ядрами атомов водорода действуют силы электростатического отталкивания, то, начиная с некоторого расстояния между атомами, эти силы начинают препятствовать дальнейшему самопроизвольному сближению атомов. Чтобы вновь разделить образовавшуюся молекулу Н2 на атомы водорода, необходимо затратить энергию (436 кДж/моль); она называется энергией связии численно равна энергии, выделившейся при образовании молекулы Н2 (—136 кДж/моль). Таким образом, образованию ковалентной связи отвечает состояние молекулы Н2 с энергетическим минимумом в 436 кДж/моль. Обобщая этот результат на процесс образования ковалентных связей между атомами других элементов, можно утверждать, что при объединении атомов в молекулы реализуется состояние с энергетическим минимумом.
Таким образом, прочность ковалентной связи обусловлена тем, что для ее разрыва всегда необходима затрата некоторой энергии.
По методу молекулярных орбиталей, процесс образования ковалентной связи в молекуле Н2 объясняется следующим образом. Однократно заселенные электроном орбитали двух атомов водорода при их достаточном сближении и перекрывании комбинируются в две молекулярные орбитали,внутри которых располагаются оба атомных ядра. Одна из этих молекулярных орбиталей (как более выгодная по энергии) оказывается полностью занятой двумя электронами (общей электронной парой), что и показано на рис. 1 (справа).
Любую молекулярную орбиталь (МО) можно трактовать, подобно любой атомной орбитали, как объем пространства в молекуле, где пребывание электронов можно обнаружить с вероятностью 90 % и где может сосредотачиваться 90 % электронной плотности одного или двух электронов в зависимости от занятости данной МО. На рис. 2 СЛ.5, представляющим энергетическую диаграмму образования связи в молекуле водорода по методу молекулярных орбиталей.
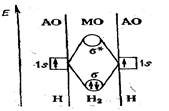
Рис. 2. Энергетическая диаграмма образования s-связи в молекуле Н2
Такую МО, занятой двумя электронами является, например, нижняя по энергии.
Ковалентная связь, при формировании которой обе взаимодействующие атомные орбитали перекрываются и комбинируются вдоль оси таким образом, что образуются вращательно-симметричные молекулярные орбитали как на рис. 1.
Ковалентная связь, при формировании которой обе взаимодействующие атомные орбитали перекрываются и комбинируются вдоль оси таким образом, что образуются вращательно-симметричные молекулярные орбитали, называется s -связью.Если в образовании s -связи участвуют со стороны обоих атомов s-АО, то для уточнения информации говорят о возникновении
s s-s-связи.
Две молекулярные орбитали, которые всегда образуются при комбинировании двух атомных орбиталей, различаются по энергии. Молекулярная орбиталь, которая оказывается более выгодной для электронов по энергии и благодаря которой атомы связываются в молекулу, называется связывающей, ее обозначают как s -МО (см. рис. 1). Другая молекулярная орбиталь, менее выгодная по энергии, чем исходные атомные орбитали, называется разрыхляющей, ее обозначают как s *-МО.
Названия «связывающая» и «разрыхляющая» МО нисходят из распределения электронной плотности в этих объемах молекулярного пространства. Связывающей МО отвечает повышенная электронная плотность в области связывания (между атомными ядрами), а разрыхляющей МО — повышенная электронная плотность в области разрыхления (по обе стороны за атомными ядрами). Распределение электронной плотности в молекулярных орбиталях наглядно показано на рис. 3 СЛ.6.

Рис. 3 Распределение электронной плотности в связывающей s (а) и разрыхляющей s* (б) молекулярной орбитали.
Таким образом, электроны на связывающих МО укрепляют химическую связь, а электроны на разрыхляющих МО ослабляют (разрыхляют) химическую связь. Вероятность пребывания электронов в связывающей МО высокая, а в разрыхляющей МО — низкая, поэтому электроны при образовании молекулы вначале занимают связывающие МО, а уж затем — разрыхляющие МО; например, на рис. 2 оба электрона двух атомов водорода оказываются при образовании s -связи на единственной s-МО.
С помощью метода молекулярных орбиталей легко объяснить, почему атомы гелия в отличие от атомов водорода или кислорода не объединяются в ковалентныё молекулы Не2. Два атома гелия имеют четыре 1s-электрона, при гипотетическом образовании молекулы Не2 первые два электрона займут s -МО (как на рис. 1), а вторые два электрона — s *-МО (которая остается вакантной в молекуле Н2, рис. 1). Квантово-механические расчеты показывают, что при равном числе связывающих и разрыхляющих электронов действие последних сильнее, и молекула, такая как Не2, не образуется. Образование таких молекул энергетически невыгодно, а стабилизирующее молекулу действие электронов на связывающих МО компенсируется (а часто превышается) дестабилизирующим действием разрыхляющих электронов. Именно поэтому существуют такие частицы, как Н+, Н2, и Не2+, но не образуются молекулярные частицы Н2- и Не2.
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 532; Нарушение авторских прав?; Мы поможем в написании вашей работы!