
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ковалентные s-связи между s- и p-орбиталями
|
|
|
|
Рис. 4. Образование ковалентной связи при перекрывание атомных p-АО.
Ковалентные s-связи между p-орбиталями
Атомные p-орбитали, подобно s-АО, при сближении соответствующих атомов могут перекрываться вдоль своей оси и комбинироваться в молекулярные орбитали (рис. 4) СЛ.7.
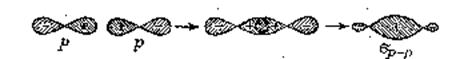
Знаки плюс и минус внутри граничной поверхности p-орбиталей (рис. 4) не относятся к электрическим зарядам (электроны всегда заряжены отрицательно), а обозначают перекрывающиеся половины каждой p-АО. Комбинирование двух p-АО приводит к образованию двух,вращательно-симметричных молекулярных орбиталей. одной связывающей s -МО и одной разрыхляющей s *-МО. Образующаяся связь является dр-p-связью.
На рис. 5 СЛ. 8 (0) показано образование s р-p-связи из двух p-АО фтора.

Рис. 5. Энергетическая диаграмма образования s-связи в молекуле F2
В образовании s -связи участвуют по одной орбитали с p-подуровня каждого атома фтора, остальные p-АО (указанные отдельно) формируют p-МО, Электроны заполняют связывающую s -МО, которая по энергии ниже, чем исходные p-АО. Оба атома фтора связываются в молекулу F2: СЛ. 8 (1).
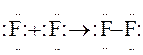
Атомные s- и p-орбитали также могут перекрываться и комбинироваться в молекулярные орбитали рис. 6 СЛ. 9.
 Рис. 6. Образование ковалентной связи при перекрывание атомных s и p-АО.
Рис. 6. Образование ковалентной связи при перекрывание атомных s и p-АО.
Перекрывающаяся половина p-АО по знаку совпадает со сферически симметричной s-АО. В результате комбинирования s- и p-АО формируются две вращательно-симметричные молекулярные орбитали: одна связывающая s -МО и одна разрыхляющая s *-МО. Образующаяся ковалентная связь называется s s-p-связью.
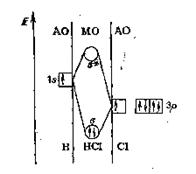
На рис. 7 СЛ. 10 представлена энергетическая диаграмма образования s s-p-связи между атомом водорода Н и атомом хлора С1.
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 467; Нарушение авторских прав?; Мы поможем в написании вашей работы!