
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ковалентные p-связи между p-орбиталями
|
|
|
|
Рис. 7. Энергетическая диаграмма образования s-связи в молекуле HCl
В образовании связи принимают участие 1s-АО водорода и одна p-АО хлора, содержащая неспаренный электрон, (не участвующие в связи остальные р-АО хлора, содержащие электронные пары, на рис. 7 указаны отдельно; s-АО хлора также не участвует в формировании связи и на рис. 7 не показана). Хлор — более электроотрицательный элемент, чем водород, поэтому p-подуровень атома хлора располагают на энергетической диаграмме ниже, чем s-подуровень атома водорода. Два электрона заполняют связывающую s -МО, которая по энергии ниже исходных 1s- и 3p-АО. Оба атома объединяются в молекулу хлороводорода: H+Cl®HCl.
В соответствии с атомной моделью Бора при образовании ковалентной связи Н—С1 создается октет валентных электронов вокруг атома хлора, но лишь дублет электронов вокруг атома водорода.
Образование химической связи возможно и между двумя атомами, содержащими валентные p-подуровни. При сближении атомов вдоль оси в первую очередь происходит перекрывание между двумя px-АО, которые и образуют s p-p -связь. Однако это не исключает последующего взаимодействия ру - и рz-АО обоих атомов. Комбинирование двух рz-АО или двух рy-АО(хотя и не настолько энергетически выгодное, как при образовании s -связи) приводит к формированию молекулярных орбиталей иного |чем s -МО) вида. Эти орбитали не являются вращательно-симметричными (какими были s s-p -МО), но лежат симметрично относительно плоскости, включающей оси х обоих атомов (рис. 8 СЛ. 11 (0)).
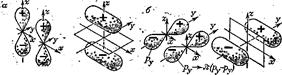
Рис. 8. Образование pp-p-связей из двух рz-орбиталей (а) и из двух ру-орбиталей (б)
Такие молекулярные орбитали называются связывающими p -МО, а образующиеся связи — соответственно p p-p-связями.
Молекулярные орбитали p -типа комбинируются из p-орбиталей одинаковой пространственной ориентации (либо из двух рy-АО, либо из двух рz,-АО).
Комбинирование различных по ориентаций орбиталей, например рy- и рz-АО, как показано на рис. 9 СЛ. 11 (1), пространственно невозможно из-за различия знаков.

|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 256; Нарушение авторских прав?; Мы поможем в написании вашей работы!