
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энергетическая диаграмма образования связей между p-орбиталями
|
|
|
|
Рис. 9. Схема, иллюстрирующая отсутствие перекрывания и невозможность образования связи между различными по ориентации p-орбиталями
В предельном случае, т. е. при перекрывании p-орбиталей всех трех ориентаций, образуются одна s -связь. Химическая s -связь — это результат прямого перекрывания p-орбиталей, а p -связи— результат бокового перекрывания p-орбиталей рис. 10 СЛ. 12.

|
Рис. 10. Перекрывание орбиталей с образованием s и p-связей: (а) прямое перекрывание по х, боковое по у и (б) прямое по у и боковое по х.
Поскольку s -связь может образовываться и без сопутствующего формирования p -связи, а p -связь, наоборот, образуется, когда первая пара p-АО уже вступила в прямое перекрывание и образовала d-связь, то различают d-составляющую и p -составляющую единой ковалентной связи.
Комбинирование шести p-АО двух связывающихся атомов даёт шесть молекулярных орбиталей: одну связывающую s- МО и одну разрыхляющую s *-МО, две связывающие p -МО и две разрыхляющие p *-МО.
Граничные поверхности p *-МО отличаются от таковых для p -МО (рис. 8), но это не существенно при трактовке связи по методу молекулярных орбиталей. Более важно, что энергия связывающих p -МО всегда ниже, чем энергия разрыхляющих p *-МО.
При наличии как минимум шести электронов на двух p-подуровнях связывающихся атомов все три связывающие МО (одна s -МО и две p -МО) окажутся занятыми электронами. Например, это реализуется в молекуле О2, так как 2р-подуровень атома О (электронная конфигурация 2s22р4) содержит четыре электрона (рис. 11 СЛ.13).

Рис. 11. Энергетическая диаграмма образования связи в молекуле О2
Из рис. 11 следует, что s5.5 -связь в молекуле О2, отсутствует, поскольку ss.s, и ss.s*- МО полностью заполнены четырьмя 2s-электронами, как и в гипотетической молекуле Не2. Поэтому далее s-подуровни атомов, заполненные двумя электронами, на энергетических диаграммах не учитываются.
Заселение молекулярных орбиталей p-электронами начинается после полного заполнения s5.5 -, и s5.5*- МО. Как низшая по энергии, сначала заполняется sp.p -МО, затем две pp-p -МО, причем каждая из них заполняется вначале одним электроном (по правилу Хунда), а затем и вторым электроном с противоположным спином. Из восьми 2s-электронов двух атомов О размещенными оказываются только шесть. По принципу минимума энергии оставшиеся два p-электрона занимают разрыхляющие pp-p *-МО, кото-рые ниже по энергии, чем sp.p *-МО.
В молекуле N2 за счет трех электронов p-подуровня каждого атома N образуется тройная s, p, p -связь: N+N®NºN.
При этом p-орбитали перекрываются, как показано на рис. 10. Образование связи в молекуле N2 по методу молекулярных орбиталей иллюстрирует рис 12 СЛ. 14.
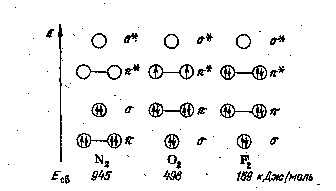
Рис. 12. Связывающие и разрыхляющие молекулярные орбитали, заполняемые p-электронами, в молекулах N2, О2 и F2 и энергия связи азот — азот, кислород — кислород и фтор — фтор
Следует обратить внимание на то, что в молекуле N2, в отличие от молекулы О2 рис. 11, связывающие p -МО расположены по энергии ниже, чем связывающая s -МО.
Отсутствие разрыхляющих электронов в молекуле N2 объясняет большое значение энергии связи азот — азот (см. рис. 12) и весьма высокую химическую инертность молекулярного азота. В противоположность этому молекулы О2 и F2 имеют соответственно два и четыре электрона на разрыхляющих p *-МО, что обусловливает значительно меньшую прочность связей кислород — кислород и фтор — фтор и высокую реакционную способность молекулярных кислорода и фтора.
Из энергетической диаграммы образования связи в гипотетической молекуле Ne2, следует, что такая молекула неустойчива и не может образовываться. Действительно, в соответствии с энергетической диаграммой молекулы Ne2 число разрыхляющих электронов равно числу связывающих электронов, т. е. связь неон — неон неосуществима, как и связь гелий — гелий.
Обобщая рассмотренные механизмы формирования ковалентных связей, можно утверждать: ковалентная связь между двумя атомами образуется тогда, когда действие хотя бы одной связывающей молекулярной орбитали не компенсируется действием разрыхляющей молекулярной орбитали.
Действительно, в молекулах N2 и F2 проявляется связывающее действие соответственно трех и одной молекулярной орбитали, тогда как в гипотетической молекуле Ne2 число связывающих МО, заполненных электронами, равно числу заселенных разрыхляющих МО.
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 763; Нарушение авторских прав?; Мы поможем в написании вашей работы!